
Die meisten Nixenschnecken fressen keine Fadenalgen, weil sie sie nicht verdauen können.


über kaum eine Schneckenfamilie in der Aquaristik ist so wenig bekannt, wie über die Nixenschnecken (Neritidae).
Nicht nur, dass Aquarianer wenig über die Biologie und Lebensansprüche wissen, die Tiere sind allgemein kaum erforscht.
Sie haben kaum wirtschaftliche, keine medizinische und nur eine sehr geringe Bedeutung als Nahrungsquelle.
Andere tropische Schnecken sind als Rohstofflieferant oder als Souvenir für Touristen von großer Bedeutung und sind auch vielfach auf den Briefmarken von Inselstaaten zu finden.
Nixenschnecken sind dagegen unbedeutend und werden kaum auf diese Weise "verewigt".
Sie sind selbst für Schalensammler kaum von Interesse.
In Gehäusesammlungen findet man meist nur die Schale ohne den Deckel.
Der zeigt aber meist die entscheidenden Artmerkmale und ohne ihn ist eine eindeutige Bestimmung nicht möglich.
Da die Färbung der Gehäuse sehr variabel ist, wurden viele Arten mehrfach beschrieben. Für nicht wenige Arten gibt es mehr als 20 Synonyme.
ähnliche Arten werden oft verwechselt oder zu einer Art zusammengefasst.
Manchmal werden auch Schnecken aus anderen Familien fälschlich für Neritidae gehalten.
In wissenschaftlichen Veröffentlichungen werden die untersuchten Tiere manchmal weder abgebildet noch beschrieben.
Das Alles macht es schwer, vorliegende Informationen den richtigen Art zuzuordnen.
Selbst die Verbreitungsgebiete lassen sich bei einigen Schnecken kaum nachvollziehen.
Hier habe ich die Informationen über die Biologie, Ökologie und Aquarienhaltung von Nixenschnecken zusammen gefasst.
Ich hoffe das es dazu beiträgt die Unterscheidung der verschiedenen Arten zu erleichtern und ihnen ein möglichst artgerechtes Leben zu bieten.
Die Systematik von Lebewesen ist eine ständig im Wandel befindliche künstliche Ordnung durch den Menschen. Es wird angestrebt mit der systematischen Einordnung ein Bild der Abstammungsverhältnisse - einen Stammbaum - zu erzeugen. Dazu werden die äußeren Merkmale und genetische ähnlichkeiten und Unterschiede untersucht. Alle neuen Erkenntnisse führen zu Veränderungen in der Systematik.

Der Name der Familie leitet sich von den Nereiden, den Meerjungfrauen oder Nixen aus den Sagen des klassischen Altertums ab.
Daher ist es sinnvoll als deutsche Bezeichnung "Nixenschnecken" zu verwenden.
Der Begriff "Napfschnecken", der zum Teil verwendet wird, ist falsch.
Zum Einen haben die Tiere gar keine napfförmigen Gehäuse, sodass die Bezeichnung unsinnig ist,
zum Anderen wird der Begriff bereits für die Patellioidea, eine nicht verwandte Gruppe von marinen Schnecken, verwendet.
Es gibt verschiedene Systeme, die in der Literatur parallel verwendet werden.
Die Bezeichnungen für die einzelnen Organisationsstufen weichen voneinander ab.
Entscheidend für die Wahl der Bezeichnung sind die gewählten Schlüsselmerkmale.
"Prosobranchia" (= Vorderkiemer) bezeichnet eine Gruppe von Schnecken, deren Kiemen vor dem Herzen liegen.
"Streptoneura" sind Schnecken, deren Nervenlängsstämme gekreuzt sind.
Beide Unterklassenbezeichnungen umfassen im Wesentlichen die gleichen Arten.
Innerhalb der Familie sind die Systematik und Nomenklatur sehr unübersichtlich.
ähnlichkeiten oder Unterschiede zu definieren scheint bei Nixenschnecken besonders schwer zu sein.
Einige Systematiker wollten zum Beispiel die Gattung Septaria in eine eigene Familie stellen, weil sie sich nach ihrer Auffassung stark von den anderen Neritidae unterscheiden.
Andere wollten dagegen Septaria und Neritina zu einer Gattung zusammenfassen, weil sie kaum Unterschiede finden konnten.
Theodoxus und Clithon wurde als Untergattung von Neritina geführt, von anderen Autoren Clithon als Untergattung von Theodoxus.
Bei Neritina wurden verschiedene Untergattungen (Vittina, Dostia, Neripteron usw.) anhand von Radulamerkmalen definiert.
Die verwendeten Kennzeichen sind jedoch nicht stabil und die Unterschiede zum Teil innerhalb einer Art größer als zwischen zwei Arten.
Daher werden diese Untergattungen nicht anerkannt und diese Bezeichnungen sollten nicht verwendet werden.
Teilweise werden sie heute aber leider sogar als Gattungsbezeichnungen gebraucht.
Die Bezeichnungen "Vittina" oder "Dostia" haben keine Gültigkeit. Es handelt sich um ein Synonym bzw. um eine veraltete, nicht anerkannte Untergattung von Neritina.
Genetische Untersuchungen zu den Verwandtschaftsverhältnissen innerhalb der Familie gibt es bisher nicht.
Es wurden nur die Chromosomen einiger Arten ausgezählt. Theodoxus-Arten (4 Arten untersucht) haben 2 n = 26 Chromosomen.
Bei den meisten bisher untersuchten Nerita (12 Arten), Neritina (4 Arten), Septaria (1 Art), Clithon (2 Arten) und Puperita (1 Art)
haben die Weibchen 2 n = 24 Chromosomen.
Eine Ausnahme stellt Neritina cornucopia dar. Bei ihr sind es 2 n = 28. Bei den Männchen ist es jeweils ein Chromosom weniger.
Schnecken, die zur überordnung der Neritimorpha gezählt werden, gab es bereits im Devon vor etwa 375 Millionen Jahren.
Charakteristisch für die Neritimorpha ist, dass die Larven während ihrer planktischen Phase zusätzlich zur embryonalen auch eine larvale Schale ausbilden.
Die typischen verkalkten Gehäusedeckel mit der unsymmetrischen Ansatzstelle entwickelten sich während der Trias (ca. 220 - 200 Mio. Jahre).
Aus der frühen Kreidezeit (ca. 196 - 200 Mio. Jahre) gibt es Funde von Muschelschalen, auf denen sich Reste von Eikokons haften, die denen heutiger Neritidae sehr ähnlich sind.
Im Verlaufe ihrer Entwicklungsgeschichte bilden sie sehr vielfältige Formen aus, die zum großen Teil zu heute ausgestorbenen Familien gehören.
Die heute lebenden aquatischen Neritimorpha werden zwei überfamilien zugeordnet.
Bei den Neritopsoidea bleiben die inneren Wände des larvalen Gehäuses erhalten und bei den Neritioidea, zu denen die Neritidae gehören, lösen sie sich auf.
Die Bestimmung fossiler Arten ist nicht einfach, weil sie allein anhand von Gehäusen erfolgen muss.
Die relevanten Merkmale sind dabei nicht immer erhalten. Hauptsächlich werden die Gattungen anhand der Schalenform und der Bezahnung an der Mündung unterschieden.
Diese fossilen Neritidae der Kreidezeit werden sechs Gattungen zugeordnet: Nerita, Otostoma, Neritoptyx, Mesoneritina, Neritoplica und Schwardtina.
Die Arten aus den letzten drei Gattungen kamen im Brack- oder Süßwasser vor. Bis auf Nerita sind alle diese Gattungen ausgestorben.
Die Gattung Otostoma gibt es seit etwa 40 Mio. Jahren nicht mehr.
Die ältesten bekannten Nerita-Arten sind Nerita umzambiensis und Nerita kaffraria aus Südafrika.
Sie wurden in einer Schicht der Oberkreide gefunden, die Santonium genannt wird und etwa 85,8 bis 83,5 Millionen Jahre alt ist.
Etwas jünger sind N. cf. bergadana aus Spanien (Campanium, 83 - 70 Mio. Jahre) und N. gemmata aus Serbien (Maastrichtium, ca. 70 - 60 Mio. Jahre).
In Abbey Woods, einem Park im Südosten von London, wurde Theodoxus psisiformis zusammen mit Nerita semilugubris, Haifischzähnen und anderen Fossilien gefunden.
Diese Tiere lebten vor dort etwa 54 Mio. Jahren in einem flachen tropischen Meer. Theodoxus buekkensis hat im späten Oligozän (vor ca. 25 Mio. Jahren) in Ungarn gelebt.
Theodoxus depressus und Theodoxus karakovensis sind Arten aus dem späten Miozän und lebten vor ungefähr 5 Millionen Jahren in der heutigen Türkei.
Smaragdia viridis ist eine Art, die es seit dem Pliozän (ca. 5 - 2,5 Mio. Jahre) bis heute gibt.
In Neuseeland wurden Fossilien gefunden, die 37 - 40 Millionen Jahre alt sind und 2011 als Neritina maxwellorum neu beschrieben wurden.
Aus dem Amazonasbecken sind Neritina-Funde bekannt, bei denen sogar noch die Muster auf den Gehäusen erhalten sind.
Sie sind etwa 18 bis 9 Millionen Jahren alt.
Auf Java und Fidschii fand man etwa 3 bis 5 Mio. Jahre alte Fossilien von Clithon corona, Clithon oualaniensis, Neritina turrita und Neritina pulligera.

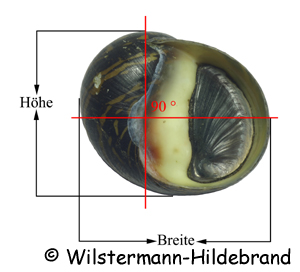
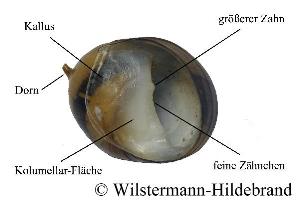
Als Erstes fallen bei der Betrachtung von Schnecken immer die Gehäuse auf. Ihre Größe Form und Farbe ist aber durch die Umweltbedingungen stark beeinflusst. Der Weichkörper ist weniger variabel und eignet sich für die systematische Einordnung deutlich besser. Bei den Neritidae ist eine eindeutige Unterscheidung der Gattungen und Arten vor allem durch die Geschlechtsorgane, die Form und Größe der Spermatophoren (Pakete aus Spermien), die Farbe und Struktur der Kolumellar-Fläche und die Gestalt des Operculums (Deckel) möglich.
Das Gehäuse der Nixenschnecken ist eiförmig, halbkugelig oder stark abgeflacht.
Die halbkugelige Gehäuseform wird, abgeleitet vom Namen dieser Familie, als "neritoid" bezeichnet.
Das Gehäuse wird von bis zu drei rechts herum gedrehten Windungen gebildet.
Die Spindel und die Wände der inneren Umgänge sind aufgelöst. Nur ein Teil der Innenwand des vorletzten Umgangs bleibt erhalten.
An ihm setzen die Muskeln an. Bei Septaria bleibt nur am hinteren Schalenrand eine schmale Wand, das Septum, stehen.
Mit Ausnahme von Septaria haben alle Neritidae ein recht kräftiges Gehäuse.
Die Oberfläche kann glatt sein oder Furchen, Rippen oder Dornen aufweisen. In der Regel ist die Ausprägung der Skulptur sehr gleichmäßig.
Das Farbspektrum reicht von Schwarz und Weiß über alle erdenklichen BrauntÖne, zu Rot, Violett, Grün und Gelb.
Die Muster zeigen mehr oder weniger gleichmäßige, feine bis breite Linien, Dreiecke, Punkte oder Flecke. Die Variabilität ist innerhalb der Arten sehr groß.
Bei Neritina- und Clithon-Arten können sich Muster und Farbe der Gehäuse nach dem Umsetzen in ein anderes Habitat verändern.
Der neu gebildete Gehäuseteil weist dann ein anderes Muster auf als der alte Teil.
Typisch für die Arten sind die Farbe und Struktur der Kolumellar-Fläche und des Mundsaums.
Die Kolumellar-Fläche ist der Bereich an der Gehäusemündung, der sich farblich von der übrigen Gehäuseoberfläche unterscheidet.
Sie ist oft glatt, kann aber bei Nerita-Arten mehr oder weniger große Knoten oder Rillen aufweisen.
Der Abschnitt des Mundsaums, der an die Kolumellar-Fläche anschließt, wird als Kolumellar-Lippe oder Kolumellaris bezeichnet.
Bei Nerita-Arten sind hier - und zum Teil auch an der äußeren Mündungslippe (Palatalis) - große Zähne.
Bei Neritina und Clithon sind die Zähne sehr viel feiner und nie an der äußeren Mündungslippe zu finden.
Neritodryas und Theodoxus haben keine Zähne an der Kolumellaris und auch bei Septaria findet man keine.
Nerita, Neritina, Neritodryas, Theodoxus und Clithon haben einen verkalkten, halbkreisförmigen Gehäusedeckel (Operculum) mit dem sie ihre Mündung verschließen können. Bei Theodoxus -, Clithon -, Neritina-Arten (mit Ausnahme von N. variegata) ist am äußeren Rand des Deckels ein Saum aus rötlichem oder braunem Horn. So einen Saum gibt es bei Nerita und Neritodryas nicht. An der Innenseite hat der Deckel eine oder zwei Apophysen. Das sind Kalkfortsätze, an denen der Muskel in der Nähe der linken Mündungsseite ansetzt. Diese Fortsätze werden als Rippe und Zapfen bezeichnet. Bei den Clithon-Arten gibt es zwischen Rippe und Zapfen eine mehr oder weniger ausgeprägte Wand. Bei Neritodryas wächst der Zapfen aus dem Rand der Rippe. Darunter ist der Deckel tief ausgehÖhlt. Bei Theodoxus fluviatilis fehlt der Zapfen. Bei Septaria ist das Operculum zwischen Fuß und Eingeweidesack in einer kleinen Tasche eingewachsen und von außen nicht sichtbar. Es ist flach und annähernd viereckig. Vermutlich stabilisiert ihr Operculum den Fuß und verbessert damit die Haftung auf dem Substrat.
Der Körper ist völlig vom Gehäuse bedeckt. Lediglich die fadenförmigen Fühler werden weit herausgestreckt, wenn sich das Tier sicher fühlt. Der Weichkörper ist grau, schwarz oder bräunlich und hat ein weißes, graues oder bräunliches Muster aus Linien oder Flecken. Der Fuß und der Kopf sind deutlich voneinander abgesetzt und beide breit und oval. Die Augen sitzen auf kleinen Erhebungen. Es handelt sich um Becheraugen vom Lochkameratyp. Sofern die Tiere genug Sehzellen hätten, könnten sie damit Bilder erkennen. Tatsächlich scheinen Nixenschnecken aber nur Licht und Schatten wahrzunehmen und reagieren darüber hinaus nicht auf Bewegungen. In der Mantelhöhle ist links eine Kammkieme (Ctenidium). Darunter ist ein Osphradium. Das ist ein chemosensorisches Organ, mit dem die Tiere riechen und schmecken können. Auf der rechten Körperseite sind die weiblichen Geschlechtsöffnungen und der Darmausgang. Der Penis sitzt am Kopf, innen neben dem rechten Fühler. Er ist deutlich länger und dicker als die Fühler. Er wird vom Gehäuse bedeckt und ist darum von außen nicht sichtbar. Bei den Septaria-Arten liegt er in einer Hauttasche unter dem rechten Fühler. Neritidae haben eine runde MundÖffnung mit wulstigen Lippen. Die Radula ist rhiphidogloss. Sie hat einen reduzierten, kleinen zentralen Rhachiszahn und rechts und links davon je einen größeren Lateralzahn mit glatter Kante. Dann folgen zwei sehr kleine Lateralzähne. Daneben steht ein großer Lateralzahn mit gesägter Kante. Diese Zähne reiben die Nahrungspartikel über das Substrat und zerbrechen dabei die Schalen von Kieselalgen. Außen in jeder Reihe sind viele, immer kleiner werdende Bürstenzähne. Bei Smaragdia, die die Zellen von Seegras anritzt, um den Saft zu saugen, ist die Radula auf zwei Lateralzähne und die Bürstenzähne reduziert. Kieferplatten zum Zerbeißen von größeren Nahrungsstücken haben Nixenschnecken nicht.




Nixenschnecken haben keine besonders spezialisierten Fortpflanzungsmechanismen entwickelt. Sie produzieren sehr viele Nachkommen, die als Larven mit der StrÖmung verdriften und neue Lebensräume besiedeln können. Lediglich in der Gattung Theodoxus schlüpfen voll entwickelte Jungschnecken.
Nixenschnecken sind getrenntgeschlechtlich. Das Geschlecht wird durch das Geschlechtschromosom X bestimmt. Bei den Weibchen liegt es als Paar (XX) in den Körperzellen vor. Bei den Männchen gibt es das X-Chromosom nur einmal (X0). Das bedeutet, dass sich die Männchen und die Weibchen einer Art dadurch unterscheiden, dass die Männchen ein Chromosom weniger haben. So hat zum Beispiel eine männliche Neritina pulligera 23 Chromosomen und eine weibliche 24. Bei den Theodoxus-Arten sind es 25 bzw. 26. äußere Geschlechtsunterschiede sind am lebenden Tier in der Regel nicht sichtbar. Der Penis und die weiblichen Geschlechtsöffnungen sind vom Gehäuse verdeckt. Lediglich bei der Paarung wird der Penis unter dem Gehäuse hervor gesteckt. Es gibt nur bei wenigen Arten einen Sexualdimorphismus. Bei Neritina latissima ist beim Männchen der Flügel auf der linken Gehäuseseite weniger ausgeprägt als beim Weibchen. Dadurch ist es bei der Paarung der WasserstrÖmung weniger stark ausgesetzt. Bei einigen Septaria-Arten sollen die Männchen etwas kleiner sein als die Weibchen. Bei Septaria suffreni haben die Männchen einen zungenartigen Auswuchs am Septum, der den Weibchen fehlt.

Neritidae haben zwei weibliche Geschlechtsöffnungen, die auf der rechten Körperseite nahe dem Anus liegen. Durch die VaginalÖffnung werden die Weibchen befruchtet.
Durch die Öffnung des Eileiters werden die Eikapseln abgelegt. Der Penis des Männchens ist am Kopf neben dem rechten Fühler.
Clithon-Arten verfügen über eine Tasche, in der sich ihr Penis im Ruhezustand befindet.
Bei den Septaria-Arten ist der Penis abgeflacht und sehr breit. Teilweise findet man in der Gattung auch mehr oder weniger lange Papillen an der Penisspitze.
Bei Septaria tessellata wurde beobachtet, dass das Männchen seinen Penis 2 bis 4 Mal in einem Zeitraum von etwa 4 Minuten in die Geschlechtsöffnung des Weibchens einführt.
Diese Kopulationen dauern etwa eine bis anderthalb Minuten. Bei Neritina crepidularia kommt es innerhalb von etwa 5 Minuten zu 4 bis 5 Kopulationen von 15 bis 30 Sekunden Dauer.
Bei der Paarung überträgt das Männchen Pakete aus Spermien (Spermatophoren) - bei einigen Septaria-Arten unverpackte Spermien - in die Geschlechtsöffnung des Weibchens.
Die Spermatophoren sind ungefähr 1 bis 1,5 cm lang und unterschiedlich gestaltet.
Bei Clithon und einigen Septaria-Arten haben sie einen langen schlanken Anhang, der als Filament bezeichnet wird.
Dieses Filament fehlt bei den Neritina-Arten. Bei einigen Arten sind deren Spermatophoren aber von einer sackartigen Hüllmembran umgeben.
Nach der Paarung werden die Spermatophoren in einen Sack nahe den Ovarien transportiert, wo sie lagern, bis die Spermien freigesetzt werden und die Eier befruchten.
Bei den Septaria-Arten, die keine Spermatophoren ausbilden, ist der Spermatophoren-Sack in der Größe reduziert oder fehlt ganz.
Shigemiya und Kato (2001) berichten, dass die Reste der Spermatophoren im Spermatophoren-Sack von Clithon retropictus
verbleiben ohne zersetzt oder ausgeschieden zu werden. Daher konnten sie an Hand dieser Reste die Zahl der Kopulationen während des gesamten bisherigen
Lebens der Weibchen bestimmen in dem sie diese zählten. Sie fanden bis zu 91 Stück in einem einzelnen Weibchen.
Im Schnitt sollen die Reste von bis zu 60 Spermatophoren in einzelnen Neritidae-Weibchen verschiedener Arten gefunden worden sein.
Haynes (2005) fand ebenfalls Reste von leeren Spermatophoren in Clithon und Neritina, macht aber keine Angaben zu
ihrer Zahl.


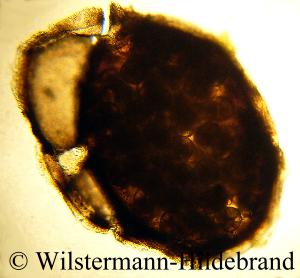
Nach ihrer Befruchtung werden in einer speziellen Drüse des Weibchens viele Eier zusammen in einen Kokon aus Conchiolin eingeschlossen und als kleines, ovales Eipaket an eine feste Unterlage geklebt.
Die Eier im Inneren sind in eine gallertige Masse eingebettet. Ein Kokon besteht aus zwei Teilen. Die untere Hälfte ist flach und haftet am Substrat.
Darüber ist eine Kuppel, die mit der unteren Hälfte entlang eines verdickten Randes verbunden ist.
Auf der äußeren Oberfläche der Kuppel sind mineralische Kristalle eingelagert, die für die einzelnen Schneckenarten charakteristisch sind und eine Unterscheidung möglich machen.
Diese Kristalle können vom Weibchen selbst produziert werden oder werden mit der Nahrung aufgenommen.
über den Verdauungstrakt werden sie zu einem kleinen Sack nahe dem Eileiter transportiert und bei der Eiablage auf den Kapseln abgelagert.
Die Kokons werden in der Nacht abgelegt. Sie sind zunächst noch weich und weiß. Im Verlauf des Tages werden sie fest und dunkler.
Septaria tessellata und Neritina crepidularia laichen zwei Tage nach einer Paarung.
Die Ablage eines einzelnen Kokons dauert 6 bis 12 Minuten. Septaria tessellata legt bis zu 24 Eikokons auf einmal, N. crepidularia bis zu 30.
Während der Paarungssaison werden von N. crepidularia bis zu 600 Eikokons in einem Zeitraum von 30 Tagen abgelegt. Bei S. tessellata wurden rund 250 gezählt.
Die Kokons enthalten 20 bis 150 Eier. Sie sind meist zwischen ein und zwei Millimeter lang, erreichen bei einigen Nerita-Arten aber auch bis zu vier Millimeter Länge.
Die Kokons von Nerita atramentosa sind 2 mm lang 1,4 mm breit. In ihnen sind 20 bis 40 Eier.
Bei Neritina crepidularia sind bis zu 100 Eier in einem Kokon von 1,5 mm Länge und 1,1 mm Breite.
Innerhalb eines Monats legt ein einzelnes Weibchen etwa 60.000 Eier.
Bei Septaria tessellata sind die Eier etwas kleiner, sodass bis zu 150 Stück in einen Kokon von 1,4 x 1 mm passen.
Neritina turrita bevorzugt als Ablageplatz für ihre Eier Hartsubstrate wie Holz und Stein.
Andere Arten legen ihre Kokons vor allem auf den Gehäusen von Schnecken ab.
Dieses Verhalten wurde unter anderem bei Neritina virginea, Neritina crepidularia und Neritina pulligera beschrieben.
Die Nutzung von Schneckengehäusen als Eiablageplatz hat mehrere Vorteile. Neritina pulligera und Neritina virginea leben zum Teil auf Laub und Schlick.
Das verrottende und leicht verdriftende Material eignet sich nicht als Unterlage für die Eikokons.
Es wurde beobachtet, das Clithon und Neritina arteigene und die Eier anderer Neritidae fressen.
Gelege auf den Gehäusen anderer Schnecken werden deutlich seltener gefressen, als andere, die frei auf Hartsubstraten abgelegt sind.
Neritina juttingae und Neritina pulligera, die im Aquarium nahezu ausschließlich ihre Eier auf den Gehäusen ihrer Artgenossen und anderer Schnecken ablegen, verlassen das Wasser nie.
In der Natur bedeutet dass, dass die Kokons auch unter Wasser bleiben, wenn der Wasserstand in längeren Trockenperioden sinkt.
Die Eier wandern mit den Schnecken immer in die Wasserzonen mit den günstigsten Lebensbedingungen.
Neritina turrita ist dagegen dafür bekannt, dass sie regelmäßig das Wasser verlässt.
Würden Eikokons auf ihrem Gehäuse haften, könnten sie bei den Landgängen austrocknen.
Bei Nerita-Arten scheinen die Gelege völlig unempfindlich zu sein.
Die Kokons werden oft so hoch auf Felsen oder an den Wurzeln und Stämmen von Mangroven in der Gezeitenzone geklebt, dass sie bei Ebbe über Wasser sein können.
Auf den Gehäusen anderer Schnecken findet man sie aber selten.
Interessant ist, dass Nixenschnecken die Eikokons aufschaben und den Inhalt fressen, wenn sich die gelegenheit bietet.
Kokons, die auf den Gehäusen von Schnecken kleben sind dabei sicherer als Kokons auf Holz oder Stein. (Kano 2010)
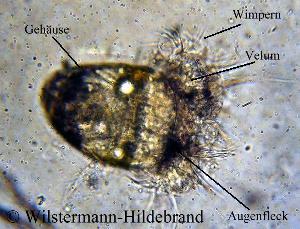
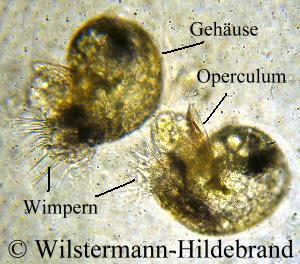

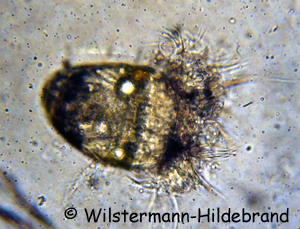
Die meisten Neritidae verlassen ihren Eikokon schon als Veliger. In diesem Larvenstadium haben sie bereits eine spiralig gedrehte Schale und einen Gehäusedeckel. Der Fuß beginnt sich zu entwickeln und es bildet sich eine Einsenkung, die einmal die Mantelhöhle wird. Charakteristisch sind zwei Segel (Vela) an deren Rand zahlreiche Wimpern sitzen. Von ihnen hat die Larve ihren Namen. Ein Veliger ist etwa 0,1 mm groß. Durch das Schlagen der Wimpern und der Vela verändert die Larve ihre Position im Wasser. Gegen die StrÖmung schwimmen kann sie nicht. Die Larven der einzelnen Arten sehen etwas unterschiedlich aus. Die Vela von Neritina turrita und Neritina juttingae haben lange Wimpern. Bei Neritina pulligera sind die Wimpern kürzer. Die Entwicklung im Ei dauert bei Neritina crepidularia und Septaria tessellata 14 bis 16 Tage und bei Neritina virginea 21 bis 28 Tage. Nerita atramentosa-Larven schlüpfen nach 14 Tagen. Bei Septaria-Arten wurde Entwicklungszeiten von bis zu 6 Monaten beobachtet. Die Entwicklungsdauer ist Abhängig von der Wassertemperatur. Bei niedrigen Temperaturen entwickeln sich die Larven langsamer und schlüpfen später. Zum Schlupf wird der Kokon gummiartig weich und die Kuppel des Kokons löst sich von der Unterlage. Die Larven werden fortgespült und treiben nahe am Grund die Flüsse hinunter bis ins Meer. Mit den MeeresstrÖmungen können die Larven bis zu 30 Kilometer am Tag verdriften. Die Larven bekommen aus ihrem Ei nur wenige Energiereserven mit und müssen Nahrung in Form von Algen und Flagellaten zu sich nehmen, während sie sich zur kriechenden Schnecke weiter entwickeln. Wie lange die Larven planktonisch leben, ist unbekannt. Im Labor konnten die Veliger von Neritina, Clithon und Septaria drei Wochen in Meerwasser am Leben gehalten werden, ohne dass sie zum Bodenleben übergingen. Möglicherweise schwimmen die Larven von einigen Arten mehrere Monate, die von anderen nur wenige Wochen. Von Hinterkiemern (Meeresnacktschnecken) weiß man, dass sie einen chemischen Reiz durch ihre Nahrungsquellen benötigen, um die Rückbildung der Vela und den übergang zum Bodenleben auszulösen. Da die Neritidae keine ausgesprochenen Nahrungsspezialisten sind, ist das bei ihnen vermutlich nicht der Fall. Möglicherweise reagieren sie aber auf Veränderungen im Salzgehalt des Wassers und lassen sich dann nahe Flussmündungen nieder. Theodoxus-Arten durchlaufen ihre gesamte Entwicklung im Kokon. Den Larven stehen in ihrem Kokon unbefruchtete Eier als Nahrung zur Verfügung. Die Zahl der Nachkommen sinkt und die Möglichkeit der passiven Verbreitung über weite Strecken ist nicht mehr gegeben. Dafür sind die überlebenschancen des einzelnen Tieres größer und die Tiere sind in der Lage ihre gesamte Entwicklung im Süßwasser zu durchlaufen.
Nach dem sie zum Bodenleben übergegangen sind, ernähren sich die Schnecken von Algenaufwuchs, Detritus und anderem organischem Material. Die Jungtiere von Neritina, Clithon, Neritodryas und Septaria wandern aus dem Meer oder dem Brackwasser die Flüsse hinauf bis ins Süßwasser. Die älteren und größeren Tiere findet man darum überwiegend weiter oben. Zum Teil sind aber auch in den unteren Flussabschnitten erwachsene Tiere und Eikokons zu finden. Ob sich hier auch lebensfähige Larven entwickeln, ist unklar. Die Tiere kriechen bei der Nahrungssuche mit und gegen den Strom, bevorzugen aber die Richtung gegen die StrÖmung. Für Neritina punctulata wurde eine durchschnittliche Wanderungsgeschwindigkeit von 16 Metern stromaufwärts in 4 Monaten bestimmt. Einzelne Tiere wanderten aber auch bis zu 200 m in 3 Monaten. Manchmal sind die Wanderungen Massenbewegungen, bei denen sich mehrere Hunderttausend Tiere versammeln. Bei N. latissima wurden schmale Tierkolonnen von mehr als 30 Metern Länge beobachtet. Tiere in solchen Aggregaten wandern schneller stromaufwärts als einzelne Individuen und legen 7 bis 15 m pro Tag zurück. Massenwanderungen unterliegen einer gewissen saisonalen Schwankung. In Japan wurde beobachtet, dass Clithon spinosus bei höheren Wassertemperaturen im Sommer (von April bis August) weiter flussaufwärts wandern, als bei niedrigeren Wassertemperaturen. In Puerto Rico fand man einen Zusammenhang mit den saisonalen Niederschlägen. Starken Regen und die damit verbundenen größeren Wassermengen im untersuchten Fluss hatten verstärkte Wanderbewegungen von Neritina virginea zur Folge. 500 - 3000 Tiere pro Quadratmeter wurden gezählt. Hauptsächlich wanderten dann Jungtiere mit einer Gehäusegröße von 5 bis 7 mm flussaufwärts. Nerita, Puperita und Smaragdia bleiben im Meer. Sie halten sich im Gezeitenbereich und im Flachwasser auf. Von Nerita atramentosa weiß man, dass sie innerhalb von 2 Jahren nach dem Ende des Larvenstadiums eine Größe von 16 mm erreicht. Geschlechtsreif sind die Tiere im Alter von etwa 20 Monaten bei einer Gehäuselänge von etwa 13,5 mm. Smaragdia bryanae ist eine endemische Art von Hawaii. Sie frisst nur das Seegras Halophila hawaiiana und nutzt es auch zur Eiablage. Die nur 2,5 bis 3 mm lange Schnecke ritzen die Seegrasblätter an und saugen den Zellsaft aus. Smaragdia viridis frisst an Zostera marina und Cymodocea nodosa. Sie ist die einzige marine Nixenschnecke, die auch in Europa - im Mittelmeer - vorkommt. Die Lebenserwartung von Nixenschnecken zu bestimmen ist nicht genau möglich. Da es sich bei den Tieren immer um Wildfänge handelt, deren Alter man nicht kennt, kann man die Zeit im Aquarium nur als Mindestlebenserwartung annehmen. Lediglich von Nerita atramentosa ist aus einer Studie die Lebensdauer von 3 bis 5,5 Jahren ab dem Ende der Larvenzeit festgestellt. Nerita albicilla und Nerita polita wurden in Meerwasseraquarien über drei Jahre und länger gehalten. Neritina auriculata und Septaria porcellana können im Aquarium drei Jahre oder länger leben. Bei Neritina punctulata konnte eine minimale Lebenserwartung von 3 bis 7 Jahren ermittelt werden. Neritina virginea ist schon über einen Zeitraum von sechs Jahren im Aquarium gehalten worden. Ihre geschätzte Lebenserwartung beträgt 8 bis 10 Jahre. Spitzenreiter ist Clithon retropictus mit einer geschätzten Lebenserwartung von etwa 20 Jahren. Neritina gagates wird nachweislich älter als 15 Jahre.

Nixenschnecken haben ein dickes, festes Gehäuse und sind damit vor vielen Feinden geschützt.
Zu den Fressfeinden von Neritina virginea gehört das Teichhuhn (Gallinula chloropus).
Während diese Rallen vor allem größere Schnecken fressen, werden die kleineren häufiger Opfer von Krebsen oder Großarmgarnelen.
Insgesamt sind die Verluste durch Räuber gering.
Von mehr als 5000 untersuchten leeren Gehäusen von Neritina virginea, wiesen nur 0,36 % Schäden durch Vögel auf und etwa 2 % waren durch Krebse beschädigt worden.
Eriphia squamata frisst Nerita funiculata und Nerita scabricosta. Nerita atramentosa ist eine mögliche Beute von Ozius truncatus.
Diese Krabben haben sehr kräftige Scheren entwickelt und können die Gehäuse der Schnecken knacken.
In den Mangroven Südostasiens und Australiens lebt die Schwimmkrabbe Scylla olivacea.
Die Tiere erreichen eine Panzerbreite von bis zu 24 cm und ein Gewicht bis 3,5 kg.
Mit ihren riesigen Scheren knacken sie Muscheln und Schnecken. Um solchen und anderen rabiaten Zeitgenossen auszuweichen, verlässt Nerita lineata das Wasser.
Tagsüber sitzen die Schnecken mehrere Meter hoch auf Mangrovenbäumen. Nachts weiden sie bei Niedrigwasser Algen von den Felsen oder den Holz.
Auch bei Flut sind sie meist oberhalb der Wasserlinie anzutreffen.
Auch größere Fische, wie die bis 50 cm langen Schläfergrundel Eleotris picta fressen Nixenschnecken.
In Malaysia wird Neritina pennata und in Australien Nerita lineata gekocht und gegessen.
Auf Hawaii sind älteren Einwohnern verschiedene Nixenschnecken als Nahrung in schlechten Zeiten bekannt.
Sie wurden als "Wai" bezeichnet, was "Hunger" bedeutet. So ist zum Beispiel Neritina granosa als "Hihi´Wai" und Neritina verspertinus als "Hapa´Wai´ bekannt.
Es ist nicht bekannt, dass Nixenschnecken Zwischenwirte für Krankheitserreger oder selbst anfällig für Krankheiten sind.
Es wurden bisher lediglich in einer Nerita-Art in Thailand Nematoden und in einer anderen aus Brasilien Sporentierchen im Mantelgewebe gefunden.

Die Systematik innerhalb der Familie und in den Gattungen ist schwierig. Die äußeren Merkmale, besonders die
Färbung, sind sehr variabel.
Die Unterscheidung der Tiere an Hand von äußeren Merkmalen des Gehäuses ist schwierig, weil es bei den meisten Arten ein sehr variables Muster aus Farben und Formen aufweist.
Wichtig für die Bestimmung der Gattungen und Arten sind vor allem der männlichen Geschlechtsapparat, die Form und Größe der Spermatophoren und die Gestalt und Farbe des Operculums.
Neritina-Arten haben abgeflachte, halbkugelige oder eiförmige Gehäuse mit glatter Oberfläche.
Ausnahmen ist Neritina granosa, deren Gehäuse mit Tuberkeln besetzt ist und Neritina juttingae mit Dornen.
Einige Clithon-Arten haben eine (z.B. C. corona, C. squarrosus) oder manchmal zwei (C.
diadema) Reihen Dornen. Clithon nucleolus hat nur einen auffälligen Dorn an der rechten Seite nahe der Mündung.
C. rarispina und C. pritchardi haben nur selten Dornen.
Andere Clithons sind glatt wie Neritina-Arten (z.B. Clithon waigiensis, C. francoisi, C. olivaceus).
Alle Theodoxus, Neritina, Clithon, Neritodryas und Nerita haben ein halbkreisförmiges Operculum mit dem sie ihre
Mündung verschließen können. Mit Ausnahme von Neritina variegata haben alle Opercula einen Saum aus Horn.
HAYNES (2005) hebt dieses Merkmal in der Artbeschreibung eindeutig hervor. STARMüHLNER (1993)erwähnt es nicht bei der Artbeschreibung, eine Abbildung zeigt aber eindeutig
ein Operculum ohne Saum.
An der Innenseite hat der Deckel eine oder zwei Apophysen.
Das sind Kalkfortsätze an denen der Muskel in der Nähe der linken Mündungsseite ansetzt.
Diese Fortsätze werden als Rippe (engl. rip) und Zapfen (engl. peg) bezeichnet.
Bei Theodoxus gibt es eine oder zwei Apophysen. Dabei scheint innerhalb einer Art beides möglich zu sein.
Die Neritina-Arten haben eine Rippe und einen Zapfen, wobei der Zapfen groß oder klein sein kann und selten ganz fehlt.
Bei Neritodryas ist die Rippe zur Spitze hin verbreitert und mit tiefen Längsrillen versehen.
Septaria ist deutlich anders gestaltet als die übrigen Neritidae.
Bei diesen Schnecken ist das Gehäuse symmetrisch, sehr flach und hat nur eine halbe Windung.
Die Unterseite hat nur am hinteren Rand ein schmales Septum und ist ansonsten offen.
Das Operculum ist flach und annähernd viereckig. Es kann eine (z. B. S. porcellana und S. tessellata) oder zwei Rippen (z. B. S. livida, S.
sanguisuga und S. cumingiana) haben.
Neritidae werden im Handel oft unter falschen Namen angeboten. Die Lebensansprüche der einzelnen Arten sind allerdings ähnlich, alle fressen Algen und keine beschädigt Pflanzen. Daher ist es unproblematisch vitale, aktive Clithon und Neritina zunächst mitzunehmen und später genau zu bestimmen. Septaria-Arten sollte man meiner Meinung nach gar nicht kaufen. Die Tiere lassen sich nicht gut in Aquarien halten und haben schon während des Transports von Asien zu uns eine sehr hohe Sterblichkeit. Solange sie aber in den Geschäften nachgefragt und gekauft werden, werden sie auch weiterhin in der Natur gesammelt und müssen zu Tausenden sterben. Zum Schutz der Tiere sollten wir als Aquarianer deshalb darauf verzichten, sie zu erwerben. Grundsätzlich gilt beim Kauf von Schnecken, dass man nur Tiere mitnehmen sollte, die aktiv herumkriechen. In einem geschlossenen Gehäuse kann sich eine lebende Schnecke befinden. Das Tier kann aber auch bereits tot sein. Wenn im Händlerbecken alle Tiere regungslos am Boden liegen, sollte man vom Kauf absehen. Da die Tiere wegen ihres planktischen Larvenstadiums nicht nachgezüchtet werden können, handelt es sich bei allen Neritina-, Clithon-, Neritodryas- und Septaria-Arten in Aquarien um Wildfänge. Während der mehrwÖchigen Transportkette und wiederholter Hälterung in Fangstationen, bei Exporteuren und Großhändlern, werden Schnecken oft nicht ausreichend gefüttert. Die Tiere sind dann bereits sehr ausgezehrt, bevor sie im Händlerbecken landen. Viele erholen sich nicht mehr. Bei aktiven Tieren ist die Chance am GrÖßten, dass sie sich im heimischen Aquarium etablieren. Viele andere Schnecken lassen sich bei Störungen fallen und ziehen sich in ihr Haus zurück. Nixenschnecken tun das nicht. Für sie ist der feste Bodenkontakt lebenswichtig. Beim "Fangen" ist darauf zu achten, dass die Tiere vorsichtig und langsam vom Untergrund gelöst werden. Der Fuß ist sehr kräftig. LÖst man die Tiere gewaltsam ab, verletzt man sie. Manchmal kann man die Tiere an der Scheibe hochschieben und an der Oberkante des vom Glas abziehen. Das Gehäuse mit leichtem Druck hin und her zu drehen kann helfen die Haftung der Schnecke an der Scheibe zu verringern. S itzen die Tiere auf kleineren Steinen oder Holz, transportiert man sie am Besten zusammen damit. Transportiert werden Nixenschnecken in Beuteln mit Wasser. Vor großer Hitze und Kälte müssen sie geschützt werden.

Viele Nixenschnecken können in tropischen Süßwasseraquarien gehalten werden.
Sie eignen sich gut für Gesellschaftsbecken mit Fischen und können auch gut zusammen mit Zwerggarnelen leben.
Wegen ihrer geringen Größe kann man sie auch gut im Nanobecken halten.
Bei pH-Werten unter 6,5 haben Schnecken zunehmend Schwierigkeiten ihr Gehäuse aufzubauen.
Dauerhaft sollte der pH-Wert darum nicht niedriger sein. Günstig sind Werte zwischen 6,5 und 7,5. Karbonat- und Gesamthärte müssen immer nachweisbar sein.
Bei den tropischen Arten sollte die Temperatur nicht dauerhaft unter 25 °C liegen.
Es werden von einigen Arten zumindest vorübergehend aber auch Temperaturen von 20 °C toleriert.
Die Kahnschnecke (Theodoxus fluviatilis) hält man besser in unbeheizten Aquarien etwas kühler.
Viele Rennschnecken verlassen regelmäßig das Wasser. Dabei finden sie zielgenau jede kleine Lücke unter der Abdeckung.
Die Tiere überleben Stürze auf den Fußboden aus 1 bis 2 m Höhe.
Werden sie nicht rechtzeitig gefunden, vertrocknen sie aber auf dem Boden.
Dicht schließende Abdeckscheiben oder das Verkleben der Kabelschächte an der Abdeckung sind darum für die Haltung von "Zebra-Rennschnecke" und "Orange Track" Pflicht.
Eine Filterung ist sinnvoll. StrÖmung schadet den Tieren nicht. Sowohl die EinsaugÖffnungen als auch die AusstrÖmÖffnung müssen so klein sein, dass die Tiere nicht in die Pumpe gelangen können.
Die Beckeneinrichtung gehören neben Pflanzen auch Holz oder Steine.
Die Schnecken kriechen zwar auch auf Kies herum, finden darauf aber keinen Halt.
Fische können sie dann leicht umdrehen. Das ist für Septaria besonders schlimm, da sie keinen Gehäusedeckel hat, um sich zu schützen.
Das sich die Tiere nicht aus eigner Kraft umdrehen können, wenn sie auf den Rücken gefallen sind, ist nicht war.
Die Schnecken tun sich schwer damit, wenn sie an feinem Kies oder Sand keinen Halt finden.
Bei grobem Kies ab etwa 10 mm KÖrnung ergibt sich das Problem nicht.
Die raue Oberfläche von Steinen und Holz sind wichtig, damit Nixenschnecken ihre Nahrung zerkleinern können.
Veralgte Steine oder Wurzeln kann man zum Putzen aus anderen Aquarien umsetzen.
In einem großen Glas auf der Fensterbank oder im Gartenteich kann man "Algensteine" zum Füttern auch leicht gezielt begrünen.
Theodoxus fluviatilis kann zum Beispiel nicht dauerhaft nur auf Glas und Pflanzen leben.
Sie verhungern, weil sie die unzerkleinerten Algenzellen nicht verdauuen können.
Einige Neritina und Clithon-Arten kann man auch im Brackwasser halten.
Es empfiehlt sich die Tiere über Wochen hinweg langsam an steigende Salzgehalte zu gewÖhnen.
Es wurde oft versucht auf diese Weise zu Nachwuchs zu kommen. Die Tiere laichen im Brackwasser, wenn sie sich eingewÖhnt haben.
Nach meiner Erfahrung Öffnen sich aber bei N. turrita, die Kokons im Brackwasser nicht.
Weder bei denen, die direkt im Brackwasser abgelegt wurden, noch bei Kokons, die zusammen mit einem Stein oder Wurzelstück ins Brackwasser umgesetzt worden sind.
Die Schnecken reagieren oft empfindlich auf Frischwasser.
Bei großen Wasserwechseln oder beim Einsetzen in nicht eingefahrene Aquarien reagieren die Tiere mit Unwohlsein.
Besonders N. turrita neigt dann dazu das Wasser zu verlassen.
Ob Chlor, Schwermetalle oder andere Substanzen im Leitungswasser der AuslÖser sind ist unklar.
Vermutlich treiben auch höhere Nitratwerte die Tiere an die Oberfläche.
Kranke und geschwächte Tiere erkennt man daran, dass sie sich nicht bewegen, ihre Fußsohle gekräuselt ist und man kann unter das Gehäuse schauen kann.
Manchmal wird verstärkt Schleim gebildet.
Außerdem mögen diese Schnecken keine Fischmedikamente und Chemikalien zur Bekämpfung von Planarien und Egeln.
Sehr giftig wirkt Panacur. Es ist schon in sehr geringen Konzentrationen für Rennschnecken tödlich.
Selbst in Aquarien, die nach der Behandlung ausgewaschen und neu eingerichtet wurden, starben die Schnecken innerhalb von wenigen Tagen.
Auch mehrere Monate nach einer Behandlung lassen sich zum Teil noch negative Auswirkungen auf die Tiere feststellen.
Auch Flubenol kann den Tieren schwer schaden. Der Einsatz von Algenbekämpfungsmittel verbietet sich in Aquarien mit Nixenschnecken von allein.
Die Tiere nutzen Algen als Nahrung. Chemische Rückstände werden mit aufgenommen.
Vor der Behandlung von Fischkrankheiten oder der Bekämpfung von Algen oder Planarien sollten Nixenschnecken darum immer aus dem Aquarium entfernt und in einem Quarantänebecken untergebracht werden.
Das Wasser muss mehrmals gewechselt und mehrere Tage über Kohle gefiltert werden, bevor die Tiere zurück können.
In einigen Fällen kann es danach trotzdem durch die Rückstände noch zu Ausfällen kommen.
Es gibt zahlreiche Erfahrungsberichte zu den verschiedenen Medikamenten, ihren Formulierungen, Konzentrationen und ihrer Wirkung auf verschiedene Wirbellose
in verschiedenen Internetforen, durch die man sich informieren kann.
Die Ernährung sollte auf pflanzlicher Kost basieren.
Sie entspricht dem natürlichen Bedürfnissen der Tiere und liefert Calcium, Rohfaser und Eiweiß in einem für die Tiere günstigen
Verhältnis. Neben Grünfuttertabletten und Algenaufwuchs (Grünalgen, Kieselalgen) fressen die Tiere auch Futterreste und Aas.
Die meisten Arten sind gut im Aquarium zu halten. Das grÖßte Problem ist, dass die Tiere von Zeit zu Zeit das Wasser verlassen und
dabei Gefahr laufen aus dem Becken zu fallen und im Zimmer zu vertrocknen.
Auch bei einem Umzug in einer Region mit anderer Wasserversorgung kann es zu Problemen kommen.
Die Tiere vertragen die Umstellung auf andere Wasserbedingungen nicht immer.
Die absolute Lebenserwartung von Neritina und Co. im Aquarium zu bestimmen ist nicht ganz genau möglich.
Da es sich bei den Tieren immer um Wildfänge handelt, deren Alter man nicht kennt, kann man die Zeit im Aquarium nur als Mindest-Lebenserwartung annehmen.
Obwohl ich seit etwa 10 Jahren Rennschnecken halte, kann ich über die Lebenserwartung der meisten Arten selbst nur wenig Aussagen treffen.
Das liegt daran, dass ich wiederholt Tiere bekommen und abgegeben habe ohne die einzelnen Tiere individuell zu unterscheiden. Ich weiß
aber, dass ich sowohl N. auriculata als auch S. porcellana über drei Jahre lang hatte.
Insgesamt sind die Kahnschnecken alle ausgesprochen langlebig.
N. gagates wird nachweislich älter als 15 Jahre (Seidl 2000).
Nach Messungen der Wuchsgeschwindigkeit des Gehäuses und der Bestimmung der Wanderungsgeschwindigkeit
wurde die minimale Lebenserwartung von N. punctulata auf 3 bis 7 Jahre geschätzt (Pyron & Covich 2003).
Laut der Artendatenbank des Arbeitskreis Wirbellose im Binnengewässer wurde auch N. virginea schon über einen Zeitraum von
mindestens sechs Jahren gehalten.
Mit Ausnahme von der marinen Smaragdia, die sich von Seegras ernährt, fressen alle Nixenschnecken Algenaufwuchs und Detritus. Sie nehmen Kieselalgen, Grünalgen und auch Cyanobakterien ("Blaualgen") auf.


Kieselalgen (Diatomeen) machen dabei in der Natur meist den grÖßten Teil aus.
Bei Untersuchungen an Theodoxus fluviatilis wurden 65 % Diatomeen, 30 % Detritus und Bakterien und 5 % Grünalgen im Magen gefunden.
Nixenschnecken können die Schalen von Kieselalgen knacken und dann den Zellinhalt verdauen.
Sie zerbrechen die Schalen in dem sie sie mit der Radula über das Substrat reiben.
Die Unterlage muss dazu aber ausreichend rau sein. Darum sitzen die Tiere bevorzugt auf Holz oder Steinen.
Nehmen die Tiere die Algen von glatten Oberflächen wie Pflanzen oder Glasflächen auf, passieren sie den Darm unbeschädigt.
Die meisten anderen Schneckenarten können Kieselalgen nicht verdauen.
Von Theodoxus fluviatilis weiß man, dass in ihrem Darm keine Zellulose zersetzende Enzyme (Cellulasen) vorhanden sind.
Das bedeutet, dass die Schnecke nicht in der Lage ist, die Zellwände von Grünalgen zu verdauen und aus ihnen Energie zu gewinnen.
Für die übrigen Neritidae gibt es solche Untersuchungen nicht. Es ist aber wahrscheinlich, dass es bei ihnen genauso ist.
Möglicherweise nehmen sie von Holz und Laub aber auch Holz zersetzende Bakterien oder Pilze mit auf, deren Enzyme ihnen bei der Verdauung helfen.
Dass die Schnecke, die Zellulose nicht nutzen kann, ist für sie ein energetischer Verlust.
Aber auch bei den Diatomeen kann sie nur die Fette, Eiweiße, Zucker und Mineralien aus dem Zellinneren verwerten.
Cyanobakterien ("Blaualgen") werden aufgenommen und können auch verdaut werden.
Ob alle Neritidae jede Cyanobakterien-Art fressen, ist fraglich.
Allerdings vertilgen die Schnecken Futterreste im Aquarium und entziehen den Cyanobakterien so die Nahrungsgrundlage.
Minimal sichtbare Algenspuren reichen nicht aus, um die Schnecken ausreichend zu ernähren.
Wenn es sich nicht um ein völlig veralgtes Becken handelt, in dem die Algen schneller wachsen, als die Schnecken fressen können, muss immer zusätzlich gefüttert werden.
Die meisten Tiere nehmen alle handelsüblichen Futtersorten an. Eine Ausnahme stellen die Septaria-Arten da.
Hier scheinen nicht alle Individuen Ersatznahrung zu akzeptieren.
Ideal ist es, wenn Nixenschnecken morsches Holz und Falllaub angeboten wird.
Die Schnecken fressen dann nicht nur das sich zersetzende Material, sondern auch die Mikroorganismen, die sich darauf ansiedeln.
Charakteristisch für die Gattung sind das Vorhandensein einer Penistasche hinter dem rechten Fühler, eine mehr oder weniger ausgeprägte Zwischenwand zwischen Zapfen und Rippe an der
Innenseite des Operculums und bei einigen Arten Dornen am Gehäuse.
An der Kolumellaris ist neben einigen feinen Zähnchen auch ein größerer Zahn, den man bei Neritina nicht findet.
Viele Clithon-Arten haben Dornen auf dem Gehäuse und werden darum als Geweihschnecken oder Kronenschnecken bezeichnet.
Besonders junge, kleine Exemplare haben oft sehr lange Dornen. Bei älteren Exemplaren können sie erodiert sein und fehlen.
Es sind verschiedene Farbformen in der Aquaristik zu finden. Rein schwarze, oliv-farbene, schwarz-gelbe und auch grau-gelb gemusterte Tiere kann man finden.
Sie werden oft für verschiedene Arten gehalten. Allerdings ist die Farbe kein Artkennzeichen.
Eine sichere Bestimmung ist nur nur an Hand von Kennzeichen am Gehäusedeckel und der Geschlechtsorgane erfolgen.
C. waigiensis ist eine Arten die nie Dornen aufweist.
Viele Clithon-Arten können gut in Süßwasseraquarien gehalten werden.
Vielfach kommen die Schnecken in den Mündungsbereichen von Flüssen vor und vertragen auch Brackwasser.
Die erwachsenen Tiere können im Brackwasser mit 1,5% Salzgehalt leben, paaren sich und legen auch Eier. Bisher ist keine gelungene Nachzucht bekannt geworden.
Es gibt aber auch Arten, die nur im Brackwasser vorkommen und sich nicht an Süßwasser gewÖhnen.

Handelsbezeichnungen:
Geweihschnecke, Teufelsdorn, Sun Snail
Heimat:
Südostasien (z. B. Thailand, Taiwan), Guam, Truk, Ponepe, Salomonen, Vanuatu, Neu Kaledonien, Samoa
Kennzeichen:
Die Beschreibungen von C. corona bei verschiedenen Autoren weichen von einander ab.
Das Gehäuse ist hellbraun bis gelblich und hat ein dunkleres Muster aus Streifen oder dreieckigen Flecken.
Besonders bei Jungtieren findet man bis zu 10 bis 6 mm lange Stacheln. Bei älteren Tieren sind die Stacheln korrodiert.
Teilweise fehlen sie ganz. Laut HAYNES (2001, 2005) ist die Kolumellar-Fläche orange mit einem schwarzen Fleck am oberen Rand.
Das Operculum ist "creamy pink". Die Tiere sollen meist zwei Reihen von Dornen haben.
Das bei ihr abgebildete Gehäuse entspricht dieser Beschreibung, hat sogar die zweite Reihe kurzer Dornen auf der linken Seite.
Laut Starmühlner (1993) ist das Operculum außen glänzend-weißlich mit einem gelblich-rötlichen Fleck am Nukleus.
Außen ist eine deutliche Bogenfurche. Innen hat es einen scharfen Grad, ist rötlich und wird zum Rand hin dunkler. Die Rippe ist weißlich und abgeplattet.
Der Zapfen ist rötlich gelb. Zwischen Rippe und Zapfen ist eine "schwach entwickelte, aufrechte Zwischenwand". Einen Hinweis auf eine zweite Reihe Dornen gibt es bei ihm nicht.
übereinstimmend geben beide Autoren eine deutliche Spiralfurche an der Außenseite des Operculums und eine raue Gehäuseoberfläche mit axialen Wuchslinien an.
In den Gehäusemerkmalen stimmt eine Clithon, die ich einmal als "Sun Snail" erworben habe, mit den Beschreibungen überein. Leider sind von den Gehäusen keine Deckel mehr vorhanden.
Ökologie:
Die Tiere sind häufig und weit verbreitet. Sie leben auf und unter Steinen in schnell fließenden Gewässern.
Man findet sie in den unteren Flussregionen bis hinein ins Brackwasser.
Wasserwerte in Habitaten von C. corona (nach Starmühlner 1993 und Haynes 1990)
| Fundort | Tonga und Samoa | New Georgia | Savai´i | Upolu |
|---|---|---|---|---|
| Temp. [°C] | 25 - 30 | 25-26 | 25 | 26 |
| pH-Wert | 6,5-8 | 6,9-7,1 | 7,1 - 7,2 | 6,6 |
| Leitwert [µS/cm] | 62,5 - 900 | 181 - 183 | 57,8 - 103,9 | 78,5 |
| CaCO3 [mg/l] | 28,4 - 356 * | 21,5 - 22,0 | 11,3 - 26,1 | 20,3 |
| °dGH | 1,6 - 20 | 1,2 * | 0,6 - 1,5 * | 1,1 * |
* errechnet





Handelsbezeichnungen:
Geweihschnecke, Kronenschnecke, TeufelshÖrnchen
Heimat:
Südostasien, Neu Kaledonien, Fiji, Samoa, Tahiti, Neuguinea
Erkennungszeichen:
Das Gehäuse ist ohne Dornen gemessen bis 2 cm lang, 1,4 cm breit und 1,1 cm hoch.
Es ist gelblich bis olivbraun gefärbt. Das Muster wird von schwarzen Spiralstreifen gebildet.
Die Streifen sind zum Teil aus einem Muster von hellen dreieckigen, mit rötlich bis schwarzen Linien gesäumten, Flecken zusammengesetzt.
Der Kolumellar-Bereich und die Mündung sind weiß. Das Operculum ist weißlich bis hellgrau mit einem orange-roten Hornrand und einem gelblichen Nukleus.
Die Oberfläche ist fein gekÖrnt und hat eine flache Bogenfurche an der Außenseite.
Die Rippe ist leicht gerippt und durch eine gerade, gut ausgeprägte Zwischenwand mit dem gelben Zapfen verbunden.
Die Dornen stehen in wachsenden Abständen auf der rechten Gehäuseseite etwas oberhalb der Naht. Die älteren sind meist abgebrochen oder auf kurze Reste reduziert.
Der längste Dorn, den ich gemessen habe, war 4,3 mm lang und befand sich an einem 10,6 mal 8,3 mm großem Gehäuse.
An größeren Gehäusen waren die Dornen alle kleiner. Ich habe bis zu neun Dornen gezählt. Wann die Dornen gebildet werden, weiß ich nicht.
Bei mir in den Aquarien hat jedenfalls bisher noch kein Tier mit dem Aufbau eines Dorns begonnen, obwohl die Tiere stetig wachsen.
Bei einigen Gehäusen steht der letzte Dorn mehr als 2 cm vom Mündungsrand entfernt. Zwischen den vorhandenen Dornen beträgt die Entfernung sonst 5 bis 7 mm.
Ökologie:
Die Tiere leben in der Nähe von Flussmündungen auf Steinen. Sie sind im Brackwasser und flussaufwärts bis in die Süßwasserbereiche zu finden.
Wasserwerte in Habitaten von Clithon diadema (nach Starmühlner 1993 und Haynes 1990)
| Fundort | Tonga und Samoa | New Georgia | Savai´i | Tutuila | Upolo |
|---|---|---|---|---|---|
| Temp. [°C] | 25,7 - 25,9 | 25-26 | 25 | 27 - 30 | 26 |
| pH-Wert | 7 - 7,6 | 6,9-7,1 | 7,1 - 7,2 | 6,4 - 7,3 | 6,6 |
| Leitwert [µS/cm] | 140 - 210 | 181 - 183 | 57,8 - 103,9 | 146 - 152 | 78,5 |
| CaCO3 [mg/l] | 40,9 - 89 * | 21,5 - 22,0 | 11,3 - 26,1 | 15,0 - 33,7 | 20,3 |
| °dGH | 2,3 - 5 | 1,2 * | 0,6 - 1,5 * | 0,8 - 1,9 * | 1,1 * |
* Werte errechnet
Haltung:
Die Tiere lassen sich problemlos im Süßwasseraquarium halten. Sie fressen Algenbeläge, nehmen aber auch Fischfutter an.

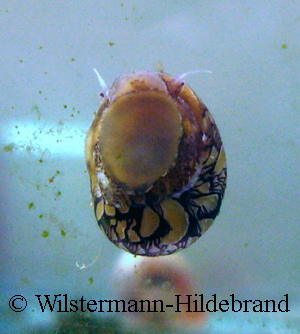
 Die kleinen Tiere sind sehr unterschiedlich gefärbt.
Die kleinen Tiere sind sehr unterschiedlich gefärbt.
Bei dieser Schnecke handelt es sich um eine Brackwasserart!
Sie kann nicht in Süßwasseraquarien gehalten werden. Manchmal werden die Tiere auch als Clithon waigiensis angeboten.
Vittina waigiensis ist aber eine andere Brackwasserschnecke.
Heimat:
Indien, Thailand, Vietnam, Singapur, Hongkong, China, Japan, Sri Lanka, Philippinen, Salomonen, Vanuatu, Neu Kaledonien, Fiji, Samoa, Tahiti, Neu Guinea, Australien (Queensland)
Kennzeichen:
Das Gehäuse ist 3 - 10 mm lang, 4-7 breit und etwa 5 mm hoch.
Die Kolumellar-Region ist sehr klein und weiß oder gelb gefärbt.
An der Kolumellaris ist ein größerer Zahn und etwa 4 kleinere.
Das Operculum ist grünlich grau und hat einen roten Hornsaum.
Der Körper des Tieres ist grünlich grau mit schwarzen Linien. Die Gehäuseoberfläche ist glänzend.
Die Grundfarbe ist gelb, orange, grün oder weiß. Die schwarzen oder rötlichen Muster ist sehr variabel und kann aus spiraligen oder gezackten Linien oder Dreiecken bestehen.
Es wurden von verschiedenen Autoren 14 bzw. 17 Musterklassen gebildet. Es konnte bisher keine genetische Fixierung des Musters festgestellt werden.
Vielmehr verändert sich das Muster in Abhängigkeit von den Umweltbedingungen.
Ökologie:
Die Tiere sind tagaktiv und an der Küste bis in etwa 40 Metern Tiefe auf Sand, Schlick auf Sandbänken, zwischen Mangroven und in Seegraswiesen.
Stellen mit starkem Wellengang werden gemieden. Clithon oualaniensis kommt auch in den Mündungsbereichen von Flüssen vor.
Ihr Vorkommen in den Flüssen ist auf die von den Gezeiten beeinflussten unteren Flussabschnitte begrenzt. Im reinen Süßwasser kommt sie nicht vor.
Sie weiden Mikroalgen von Felsen und Seegras und fressen Detritus.
Die Wassertemperaturen in ihrem Lebensraum liegen zwischen 23 und 29 °C.
In Hongkong wurden Salzgehalte von 20 - 30 Promille in Seegraswiesen mit Clithon oualaniensis gemessen.
Die Tiere zeigen normales Veralten bei 15 - 30 Promilla Salzgehalt. Bei niedrigeren Salzgehalten (0 oder 7 Promille) waren die Tiere in Laborexperimenten inaktiv.
Haltung:
Die Haltung ist im Brackwasser mit etwa 13 - 15 g Salz pro Liter Wasser möglich.
Die Temperatur sollte bei 25 bis 30 °C liegen. Die Tiere fressen Algenaufwuchs und nehmen auch Spirulina-Futtertabletten an.
Von der Haltung im Süßwasser gibt es keine positiven Erfahrungsberichte. Die Tiere sterben innerhalb von wenigen Tagen oder Wochen.
Die typischen Rennschnecken, Zebraschnecken, Stahlhelmschnecke und die Batman-Schnecke gehören zu dieser Gattung.
Sie haben dicke, glatte Gehäuse ohne Dornen.
Bei einigen Arten sind sie eiförmig mit deutlich sichtbaren Windungen, andere Arten sind halbkugelig und die letzte halbe Windung umfasst die anderen fast vollständig.
An der Kolumellar-Lippe sind feine, oft kaum erkennbare Zähnchen. Bei N. coromandeliana sind die Zähnchen recht auffällig und groß.
Die Mündung ist halbkreisförmig und kann mit dem Operculum verschlossen werden.
Teilweise ist der Mundsaum flügelartig verbreitert (N. latissima, N. auriculata, N. violacea).
Abgesehen von N. variegata haben alle Arten am Gehäusedeckel einen hornigen Rand. Die Spermien werden als Spermatophoren übertragen.
Die Spermien werden als Spermatophoren übertragen. Die Spermatophoren haben nie ein Filament, können aber in eine umhüllende Membran verpackt sein (N. variegata, N.turrita).


Die Batman-Schnecke verfügen auch über Verbreiterungen an den Gehäuseseiten, die eine Anpassung an schnell strömende Gewässer sind.
Die Auswüchse zeigen an beiden Gehäuseseiten nach hinten und haben einen kreativen Menschen wohl an die Flügel einer Fledermaus erinnert.
Daher stammt der merkwürdige Trivialname.
Handelsbezeichnungen:
Batman-Schnecke, Fledermausschnecke, "Neritina tahitensis", "Neripteron auriculata"
Heimat:
Südostasien, Salomonen, Vanuatu, Neu Kaledonien, Fiji, Samoa, Tahiti, Neuguinea
Kennzeichen:
Das Gehäuse ist bis etwa 1,5 - 2 cm lang, 1,2 - 1,6 cm breit und 0,6 - 0,7 cm hoch.
Es ist flach und hat am Hinterrand flügelartige Verlängerungen, die bei den verschiedenen Populationen unterschiedlich stark ausgeprägt sind.
Die Oberseite ist hellbraun bis schwarz.
Der Bereich der Columellaris ist sehr breit und weiß-grau bis cremefarben.
Das Operculum ist außen grau und innen hellbraun mit grauen Linien. Es hat einen roten Hornsaum. Die Rippe ist weiß und der Zapfen orange.
Ökologie:
Die Art ist weit verbreitet, aber nicht so häufig wie andere Arten.
Die Tiere leben im Brackwasser zwischen den Mangroven aber auch in den offenen Mündungsbereichen.
Sie kommen auch im von den Gezeiten beeinflussten Süßwasser führenden Flussabschnitten vor.
In Singapur leben die Schnecken auf Steinen in der StrÖmung von Mangrovenflüssen. Die Wassertemperatur schwankt dort zwischen 26 und 32 °C.
Die Tabelle gibt die Wasserwerte in Habitaten von Neritina auriculata (nach Starmühlner 1993 und Haynes 1990) an.
| Fundort | Tonga und Samoa | New Georgia | Savai´i | Tutuila |
|---|---|---|---|---|
| Temp. [°C] | 25 - 25,7 | 25-26 | 25 | 27 - 30 |
| pH-Wert | 6-6,9 | 6,9-7,1 | 7,1 - 7,2 | 6,4 - 7,3 |
| Leitwert [µS/cm] | 76-140 | 181 - 183 | 57,8 - 103,9 | 146 - 152 |
| CaCO3 [mg/l] | 35,6 - 89 | 21,5 - 22,0 | 11,3 - 26,1 | 15,0 - 33,7 |
| °dGH | 2,0 -5,0 | 1,2 * | 0,6 - 1,5 * | 0,8 - 1,9 * |
* errechnet
Haltung
Die Batman-Schnecke gehört zu den weniger gut haltbaren Schnecken-Arten mit hoher Sterblichkeit.
Möglicherweise werden die Tiere im Brackwasser gesammelt und schaffen die Umstellung auf Süßwasser nicht alle.
Eventuell spielt aber auch eine mangelhafte Futterversorgung während der Zeitspanne vom Sammeln über die Hälterung beim Exporteur, Großhändler und Fachhändler bis in unsere Aquarien eine
Rolle. Tiere, die sich etablieren, können mehrere Jahre im Aquarium leben.
Die Art ist weder bei Starmühlner (1993) noch bei Haynes (2005) behandelt, die sich nur mit Süßwasserarten beschäftigt haben.
Reeve (1856) führt eine Neritina zigzac var. coromandeliana auf, der er die Synonyme N. trinagularis, N. insignis und N. pulcherrima zuordnet.
Diese Schnecke ist nach seiner Beschreibung oliv mit einer schwarzen Dreieckzeichnung.
Gehäuse, die denen von Neritina coromandeliana nach der Beschreibung von Tan & Clements entsprechen, werden zum Teil auch als Farbformen von Neritina communis eingestuft.
Heimat:
Das Verbreitungsgebiet reicht von Ostindien bis zu den Philippinen.
Kennzeichen:
Das eiförmige Gehäuse ist pink-violett mit schwarzen Streifen, wirkt aber bei intaktem Periostrakum braun mit schwarzen Streifen (Brown 1994).
Es ist bis 28 mm hoch und 24 mm breit. Die Kolumellar-Region ist grau-weiß und glatt.
Am Rand sind deutliche Zähnchen. Das Operculum ist glatt, grau-braun mit rotem Hornsaum.
Ökologie:
Die Tiere leben auf Holz und Laub in den Mangroven von Indonesien und Malaysia.
Nach der Beschreibung bei Tan und Clements (2008), kann ich ausschließen, dass ich diese Art je gesehen habe.
Ich habe keine grau-braunen Opercula finden können und keines der Gehäuse hat so deutliche Zähne am Kolumellar-Rand. Auch
die pinke bis metallisch violette Färbung, die man bei C. coromandeliana sehen sollte, fehlt bei allen mir bekannten Exemplaren.
Daher gehe ich davon aus, dass es bei den Tieren, die als Neritina coromandeliana angeboten werden, um Neritina turrita handelt.
Heimat:
Das Verbreitungsgebiet umfasst Südafrika, Madagaskar, die Seychellen und die Inseln im Indischen Ozean.
Kennzeichen:
Die Gehäuse sind glatt mit gelb-brauner Grundfarbe über die schwarze Bändern gezeichnet sind. Teilweise ist die helle Grundfarbe auf nur wenige Flecken reduziert.
Diese Beschreibung nach Brown (1994) ist relativ oberflächlich und macht einen Vergleich schwer.
Bei Haynes (2005) sind Penis, Spermatophore und Operculum abgebildet. In allen drei Merkmalen unterscheidet sie sich von N. turrita.
Ökologie:
Die Tiere leben in Flüssen mit Gezeiteneinfluss auf Felsen.
Anmerkungen:
Da selten Schnecken aus Afrika und aus dem Gebiet des Indischen Ozeans importiert werden und die meisten aus Asien stammen, ist es unwahrscheinlich, dass diese
Art in unseren Aquarien lebt.






Heimat:
Die Tiere kommen wahrscheinlich auf Borneo und Sumatra, sowie auf Pulau Panaitan vor. Wie groß das Verbreitungsgebite ist, ist unbekannt.
Handelsbezeichnungen
Fruit Snail
Kennzeichen:
Das halbkugelige Gehäuse ist etwa 1,8 bis 2,5 cm lang und 1,5 - 2 cm breit.
Es ist im Vergleich zu dem anderer Neritina-Arten recht dünnwandig.
Auf der Oberfläche sind 10 - 12 Spiralrippen, auf denen in unregelmäßigen Abständen kurze, offene Dornen stehen können.
Bei einigen Exemplaren sind die Dornen stark ausgeprägt, andere haben nur die Spiralrippen.
Die Oberfläche ist hell braun, wirkt aber oft durch schwärzliche Beläge dunkel.
Die Kolumellar-Fläche ist weiß. Entlang des Mundsaums ist ein mehr oder weniger intensiver orange-gelber Ring.
Das Operculum ist rot-braun mit rotem Hornsaum. Wenn es trocken ist, wirkt es weißlich. Rippe und Zapfen sind rot. Der Zapfen ist auffallend schmal.
Die Eikokons haben eine sehr glatte gleichmäßige Oberfläche. Eingebettete Kristalle oder andere Strukturen habe ich bisher nicht darauf gesehen. Die Veliger haben lange Wimpern an den Vela.
Ökologie:
Diese Schnecke lebt im Süßwasser auf und unter Steinen, sowie im Detritus.
Die Schnecke wurde auf Borneo (Sarawak) gefunden. Dort leben ausgewachsene Tiere in einem langsam strömenden Fluss.
Der Bodengrund am Fundort besteht aus Sand und grobem Schotter.
Die Schnecken saßen an Steinen, die zur Befestigung einer Brücke in den Fluss geworfen worden sind.
Der Fundort liegt etwa 3 bis 4 Kilometer oberhalb der Gezeitenzone. An der Stelle wachsen Cryptocoryne bullosa.
Wasseranalysen von dem Habitat liegen nicht vor. Die Tiere leben auf und unter Steinen.
Sie verlassen das Wasser nicht und bevorzugen zur Eiablage die Gehäuse von Artgenossen und anderen Schnecken.
Haltung:
Die Tiere sitzen am Tag bevorzugt auf oder unter Holz und Steinen. Man findet sie aber auch unter Laub.
Nachts kriechen sie auf der Futtersuche auch über das offene Substrat.
Sie fressen im Aquarium gerne Laub, nehmen aber auch Kaninchenpellets und Fischfutter problemlos an.
In einem Aquarium mit Laub und Holz findet man sehr viel mehr Eikokons von Neritina juttingae als in einem Becken ohne Laub mit der gleichen Anzahl von Schnecken.
Ist das Laub verbraucht werden weniger Kokons produziert. Die Tiere verlassen das Wasser normalerweise nicht.



Diese Art wurde 2003 von einem Aquarianer aus Mexiko mitgebracht und als "Mexikanische Napfschnecke" über einen Zooladen in Berlin verkauft.
Ob die Tiere über den Großhandel importiert werden/wurden ist zweifelhaft. Die Tiere haben sich als sehr haltbar erwiesen. Allerdings konnte ich sie nur einmal bekommen und
weiß nicht, ob sie überhaupt noch im Aquarium gehalten werden.
Handelsbezeichnungen:
Mexikanische Napfschnecke
Heimat:
Pazifik-Küste von Panama, Mexiko, Peru, Costa Rica
Kennzeichen:
Das Gehäuse ist sehr flach und an den Seiten flügelartig verbreitert.
Es ist 2 bis etwa 2,4 cm lang, 1,8 - 2,3 cm breit und etwa 1 cm hoch.
Die Grundfarbe ist hellbraun. Darüber liegen feine, graue, braune, schwarze oder violette Linien, die ein schuppenartiges Muster bilden.
Der Kolumellar-Bereich ist cremefarben. Das Operculum ist innen und außen grau, flach und glatt.
Der Hornsaum ist intensiv rot. Die Rippe und der Zapfen sind gelb.
Es gibt am Gehäuse einen deutlich sichtbaren Sexualdimorphismus.
Bei den Weibchen ist das Gehäuse auf beiden Seiten mit jeweils einem Flügel verbreitert.
Beim Männchen fehlt dieser auf der linken Körperseite.
Bei der Paarung steht dieser Teil des Gehäuses senkrecht im Wasser und bietet einen hohen
StrÖmungswiderstand, der durch den Flügel nur vergrößert würde.
Kriechen die Tiere jedoch flach über das Substrat, werden sie bedingt durch ihre Form von der StrÖmung nach unten gedrückt und
benötigen darum weniger Kraft um sich festzuhalten.
Ökologie:
Die Tiere kommen im Brack- und Süßwasser vor. In Gezeitenpools, in denen Tiere gefunden wurden, lag der Chloridgehalt bei 1982 mg/l.
In den Flüssen wurden etwa 15 - 40 mg/l Chlorid gemessen.
Die Schnecken leben sowohl in Pools mit stehendem Wasser, als auch in strÖmungsreichen Flussabschnitten mit einer StrÖmungsgeschwindigkeit von etwa 0,7 m/s.
In Bereichen mit vielen Turbulenzen (ca. 1,9 m/s) findet man nur wenige und kleinere Tiere, die nahe dem Grund an den Steinen sitzen.
Bei geringerer StrÖmung sind die Schnecken größer und halten sich weiter oben auf den Steinen auf.
In Costa Rica wandert N. latissima während der Trockenzeiten in Gruppen von mehr als 500.000 Tieren die Flüsse hinauf.
Dabei legen sie innerhalb von wenigen Wochen mehrere Hundert Meter zurück.
Die Tiere wandern in bis zu 32 m langen Karawanen in einer Linie den Fluss hinauf.
Es wird vermutet, dass nur Jungtiere in ihrem ersten Lebensjahr und eventuell noch etwas darüber hinaus flussaufwärts wandern.
ältere, größere Tiere wandern nicht.
In den Kokons, die oft auf den Gehäusen von Artgenossen kleben, sind 40 bis 50 Eier.
Die Veliger schlüpfen nach zwei Monaten. Im ersten und zweiten Lebensjahr wachsen die Jungschnecken jeweils 9 bis 11 mm in die Länge und 8 bis 11 mm in die Breite.
Ab einer Länge von etwa 15 mm nimmt die Wuchsgeschwindigkeit ab. Tiere mit mehr als 20 mm Gehäuselänge sind in der Natur selten.
Wasserwerte aus den Habitaten von Neritina latissima aus dem Río Pánica und Quebrada Colorada in Costa Rica, Minimum- und Maximumwerte aus der Zeit von April 1977 bis Dezember 1978
| Fundort | Río Pánica | Quebrada Colorada |
|---|---|---|
| Wassertemp. [°C] | 25 - 29,5 | 25 - 28 |
| Chlorid [mg/l] | Feb 14 | 14 - 25 |
| Calcium [mg/l] | Feb 14 | 14 - 25 |
| Sauerstoff [mg/l] | 6,7 - 8,0 | 7,9 - 11 |
Haltung:
Die Tiere weiden Algenaufwuchs ab und nehmen Ersatzfutter an. Sie leben problemlos mehrere Jahre im Süßwasseraquarium. Ich habe nie beobachtet, dass sie das Wasser verlassen.
Die Schnecken haften sehr fest am Untergrund und lassen sich nur mit gleichmäßigem, sanftem Zug von der Unterlage lösen.
Im Süßwasseraquarium sind die Tiere sehr aktiv und gut haltbar. Sie sind auch tagsüber gut zu beobachten.
Mit der Fortpflanzung ist es wie bei den anderen Arten. Die weißen Kokons sind etwa 1 mm lang, oval und sehr flach. Sie
werden verstreut an andere Schnecken, Steine und die Aquariumscheiben geklebt. Dabei werden Winkel und Kanten bevorzugt.
In einer Nacht werden von einem Weibchen 3-15 (möglicherweise auch mehr) Eikokons abgelegt. Aus diesen schlüpfen im Süßwasser Larven.
Diese treiben in der Natur in Meer und ernähren sich da von Plankton. Eine Nachzucht im Aquarium ist entsprechend schwierig und bisher nicht gelungen.
Die gesicherten Angaben zu dieser Schnecke sind spärlich.
Ob es sich um ein Synonym von N. gagates handelt kann ich nicht sagen, teilweise wird es angenommen.
Heimat:
Die Art kommt in Ostafrika (Somalia bis Mozambique) und Südafrika vor.
Kennzeichen:
Diese Art ist wohl heller als Neritina gagates gezeichnet und etwas gedrungener.
Die Bilder bei Brown (1994) zeigen Tiere mit einem dicken Netzmuster aus schwarzen Linien auf hellem Grund.
Ökologie:
Die Tiere Leben in Mangrovensümpfen entlang der Küste.
Anmerkungen:
Bei den Schnecken, die im Aquarienhandel unter diesem Namen zu finden sind, handelt es sich um Neritina turrita.

Handelsbezeichnungen
Neritina spec. "Diamant", Mosaik-Rennschnecken, Ornament-Rennschnecke
Heimat
Die Tiere kommen auf Borneo vor. über das Verbreitungsgebiet ist sonst nichts bekannt.
Kennzeichen
Die Gehäuse sind halbkugelig und etwa 1,8 - 2,5 cm lang und 1,4 - 1,6 cm breit.
Sie sind braun mit schwarzem Muster aus kleinen Dreiecken.
Die Kolumellar-Fläche ist weiß bis lachsfarben mit einem dunklen Fleck. Die Kolumellaris ist fein gezähnt.
Der Mundsaum ist weiß bis gelblich. Das Operculum ist außen cremefarben bis schwarz. Innen ist es cremefarben bis rötlich braun.
Die Rippe ist weißlich, der Zapfen braun-rot. Am Rand ist ein orangefarbener Hornsaum.
Literatur zu der Art ist rar.
Bei Tyron (1885) ist die Schnecke abgebildet (plate 20, 33) und kurz beschrieben.
Als Verbreitungsgebiet wird das Ostindische Archipel angegeben.
Auch bei Reeve (1856) gibt es eine gute Abbildung (Neritina plate 4, Nr. 19 a und b).
Dort findet man sie unter dem Synonym Neritina piperina Chemnitz.
Ökologie
Die Tiere wurden zusammen mit Neritina juttingae gefunden.
Das Substrat ist kiesig aber mit groben Steinen durchsetzt.
Die Schnecken sitzen an größeren Steinen. Wasserwerte liegen nicht vor.
Der Fundort ist etwa 3 bis 4 km oberhalb der Brackwasserzone.
Haltung
Mit dieser Art habe ich keine eigenen Erfahrungen. Da sie zusammen mit Neritina jutingae vorkommt, vermute ich,
dass sie von der in ihren Ansprüchen und im Verhalten wenig unterscheidet.





Manchmal wird der Name als Synonym von Neritina violacea aufgeführt, es handelt sich aber um eine eigenständige Art.
Handelsbezeichnungen:
Stahlhelm-Rennschnecke, Militärhelmschnecke oder O-Ring-Snail
Heimat:
Südafrika, Kenia, Madagaskar, die Andamanen, Südostasien, Palau, Guam, Ponepe, Salomonen, Vanuatu, Neu Kaledonien, Fidschi
Kennzeichen:
Das Gehäuse ist bis etwa 1,4 - 2,7 cm lang, 1,1 - 2 cm breit und 0,7 - 1,5 cm hoch.
Es ist halbkugelig und braun. Jungtiere haben oft eine schwarze Zeichnung mit feinen quer verlaufenden Linien.
Bei älteren Tieren ist das Gehäuse oft mit schwarzen Ablagerungen bedeckt.
Wuchslinien sind als feine Querrillen sichtbar. Die Kolumellar-Fläche ist an den Seiten gelb-orange und in der Mitte grau bis schwarz.
Der Mundsaum hat einen gelb-orangen Ring. Das Operculum ist hellbraun mit grauen Linien und einem roten Hornsaum.
Die Rippe ist weiß und gelblich. Der Zapfen ist gelb-orange. Der Veliger hat einen gleichmäßigen Wimpernkranz am Rand der Vela.
Ökologie:
Diese Art kommt in Flüssen in Süßwasser auf Steinen und Laub vor.
Die Tiere kleben ihre Eikokons fast ausschließlich auf die Gehäuse ihrer Artgenossen.
Seltener findet man sie auf Holz oder vereinzelt an der Aquarienscheibe.
Sie sind meist in einer oder zwei Reihen in Gruppen von 4 bis 10 angeordnet. In den einzelnen Kokons sind etwa 10 - 20 Larven.
Wasserwerte in Habitaten mit Neritina pulligera (nach Haynes 1990)
| Fundort | New Georgia | Savai´i | Tutuila | Ponepe |
|---|---|---|---|---|
| Temp. [°C] | 25-26 | 25 | 27 - 30 | - |
| pH-Wert | 6,9-7,1 | 7,1 - 7,2 | 6,4 - 7,3 | - |
| Leitwert [µS/cm] | 181 - 183 | 57,8 - 103,9 | 146 - 152 | 21 - 104 |
| CaCO3 [mg/l] | 21,5 - 22,0 | 11,3 - 26,1 | 15,0 - 33,7 | 6,0 - 46 |
| °dGH | 1,2 * | 0,6 - 1,5 * | 0,8 - 1,9 * | 0,3 - 2,6 * |
* Werte errechnet
Haltung:
Die Schnecken können bei Temperaturen zwischen 22 und 28 °C im Süßwasseraquarium gehalten werden. Sie schädigen keine
Pflanzen und sind für andere Tiere ungefährlich. Es sollte - wie bei anderen Schnecken auch - genug Calciumkarbonat im Wasser sein,
damit sie problemlos ihr Gehäuse aufbauen können.
Ursprünglich wurde die "Batman-Schnecke" für Neritina tahitensis gehalten. Mittlerweile wurden diese Tiere aber als Neritina auriculata identifiziert.
Neritina tahitiensis wird nicht im Aquarium gepflegt.
Heimat:
Sie kommen auf den Philippinen, den Salomonen, Fidschi, Neu Kaledonien, Vanuatu, Samoa und FranzÖsisch Polynesien vor.
Kennzeichen:
Das Gehäuse hell braun mit einem Muster aus feinen roten oder schwarzen Linien. Es ist flach und hat am Rand flügelartige Verbreiterungen.
Der Bereich der Kolumellaris ist sehr breit und grau bis orange-braun.
Die Mündung ist weiß-blau. Das Operculum ist hell braun und hat einen rot-braunen Hornrand.
Ökologie:
Die Tiere leben auf Steinen nahe Flussmündungen, oft auch im Brackwasser.
Anmerkungen:
Diese Art ist nicht im Aquarianehandel zu finden und für die Aquaristik wahrscheinlich auch völlig ungeeignet.




Die "Rennschnecke" ist unter sehr vielen verschiedenen Namen bekannt.
Einige der verwendeten lateinischen Bezeichnungen sind Synonyme und andere beschreiben andere Arten.
Neritina semiconica ist z. B. ein Synonym von Neritina turrita.
Neritina gagates Lamarck 1822 ist eine andere Art, die an den Küsten von Südafrika, Madagaskar, den Seychellen und den Inseln im Indischen Ozean vorkommt.
Neritina coromandeliana ist ein anderer Name von Vittina coromandeliana.
Handelsbezeichnungen:
Zebra-Rennschnecke, Orange-Treck, Traktorspur-Rennschnecke, Neritina semiconica, Vittina semiconica, Neritina gagates,
Neritina coromandeliana, Vittina coromandeliana und andere
Heimat:
Südostasien, Taiwan, Palau, Guam, Salomonen, Neu Kaledonien, Fiji, Samoa, Tahiti, Neu Guinea
Kennzeichen:
Das Gehäuse ist dickwandig und eiförmig. Es wird etwa 1,4 - 2,7 cm lang, 1,0 - 1,8 cm breit und 0,7 - 1,5 cm hoch.
Das Muster besteht aus feinen Linien, mit breiten Streifen oder mit einem in Spirallinien angeordneten Muster aus Punkten oder feinen Strichen.
Die Farbform "Orange-Treck" hat ein spiralig angeordnetes Muster aus Flecken und Strichen.
Man kann bei dieser Art oft beobachten, dass nach Veränderung der Umweltbedingungen der Neuzuwachs am Gehäuse ein anderes Muster aufweist als das ursprüngliche.
Streifen können breiter oder schmaler werden, ihre Richtung verändern oder ganz verschwinden.
Die Kolumellar-Region ist gelblich bis orange. Das Operculum ist rosa bis orange und hat einen schmalen roten Hornsaum.
Die Weibchen legen etwa 15 bis 20 Eikokons auf einmal in lockeren Reihen auf Holz oder Steinen ab.
Jeder Kokon enthält etwa 50 Eier. Der schlüpfende Veliger ist etwa 0,1 mm groß und hat zwei Vela mit langen, zottigen Wimpernkränzen.
Ökologie:
Die Tiere leben auf Schlamm, Steinen und Holz im Brackwasser im Mündungsbereich von Flüssen, zwischen Mangroven und bis über die Gezeitenzone hinaus im Süßwasser.
Wasserwerte in Habitaten von Neritina turrita (nach Haynes 1990)
| Fundort | New Georgia | Savai´i | Tutuila |
|---|---|---|---|
| Temp. [°C] | 25-26 | 25 | 27 - 30 |
| pH-Wert | 6,9-7,1 | 7,1 - 7,2 | 6,4 - 7,3 |
| Leitwert [µS/cm] | 181 - 183 | 57,8 - 103,9 | 146 - 152 |
| CaCO3 [mg/l] | 21,5 - 22,0 | 11,3 - 26,1 | 15,0 - 33,7 |
| °dGH | 1,2 * | 0,6 - 1,5 * | 0,8 - 1,9 * |
* Werte errechnet
Haltung
Die gut bekannte "Rennschnecke" ist bereits seit etwa 15 Jahren in unseren Aquarien zu Hause.
Die Tiere lassen sich im Süß- und Brackwasseraquarium problemlos über mehrere Jahre pflegen.
Fischfutter in jeder Form wird gefressen. Algenbeläge werden gründlich von Pflanzen, Einrichtungsgegenständen und der Aquarienscheibe abgeweidet.
Diese Schnecke verlässt leider regelmäßig das Wasser. Ein ausbruchssicheres Aquarium ist hier Pflicht.




Handelsbezeichnungen
Batikschnecke
Dies ist eine von zwei Arten, die als Batikschnecke im Handel ist. Die Andere ist bei Bitter (2008)
als Vittina variegata bezeichnet. Dabei handelt es sich um Neritodryas cf. dubia.
Heimat:
Südostasien, Palau, Guam, Salomonen, Trum, Ponepe, Vanuatu, Neu Kaledonien, Fidschii, Samoa, Tahiti, Neu Guinea
Kennzeichen:
Ihr Gehäuse ist etwa 1,7 - 2,5 bis cm lang und 1,8 bis 2,2 cm breit.
Es ist ungefähr 1,4 cm hoch. Es ist schwach kegelförmig mit einem wenig erhobenen Apex.
Die Körperwindung ist groß. Die Grundfarbe ist hell bis dunkel braun.
Das Muster besteht meist aus schwarzen, breiten Zick-Zack-Linien, die zu einem Netzmuster zusammenfließen können.
Die Oberfläche ist fast glatt. Nur eine ganz feine Spiralrillen sind sichtbar.
Die Kolumellar-Fläche ist weiß mit einem orangen bis rot-braunen Fleck am oberen Rand.
Die Kolumellaris hat 6 bis 13 feine Zähne. Der Oberste und der Unterste sind etwas breiter, als die anderen.
Das Operculum ist schwarz mit einem weißen Fleck am Nukleus.
Manchmal auch mit Aufhellung entlang des Randes. Der Deckel hat keinen Hornsaum.
Die Rippe ist sichelförmig und an der Spitze etwas verbreitert. Der Zapfen ist kräftig.
Ökologie:
Die Tiere leben auf Steinen und Felsen in Flüssen mit schnell oder langsam fließendem Wasser (30 - 50 cm/s).
N. variegata lebt in den Unterläufen von Flüssen im oberen Gezeitenbereich und darüber. Bei Flut sind sie im unteren Verbreitungsgebiet auch im Brackwasser.
Sie kommen zusammen mit Melanoides tuberculata, Clithon corona und anderen Neritidae vor.
Wasserwerte in Habitaten von Neritina variegata (nach Starmühlner 1993 und Haynes 1990)
| Fundort | Tonga und Samoa | New Georgia | Savai´i | Tutuila |
|---|---|---|---|---|
| Temp. [°C] | 25 - 25,7 | 25-26 | 25 | 27 - 30 |
| pH-Wert | 6-6,9 | 6,9-7,1 | 7,1 - 7,2 | 6,4 - 7,3 |
| Leitwert [µS/cm] | 76-140 | 181 - 183 | 57,8 - 103,9 | 146 - 152 |
| CaCO3 [mg/l] | 35,6 - 89 | 21,5 - 22,0 | 11,3 - 26,1 | 15,0 - 33,7 |
| °dGH | 2,0 - 5,0 | 1,2 * | 0,6 - 1,5 * | 0,8 - 1,9 * |
* Werte errechnet
Haltung
Die Aquarienhaltung ist unproblematisch, da die Tiere außer Algen auch Fischfutter annahmen. Sie verlassen von Zeit zu
Zeit das Wasser. Eine dicht schließende Abdeckung ist darum wichtig.



Diese Tiere wurden einige Jahre nach Neritina pulligera für die Aquaristik entdeckt.
Die Art kommt mit Neritina cornucopia zusammen vor.
Beide sind sich recht ähnlich und werden in der Literatur beide auch als "Dostia violacea" bezeichnet.
Neritina cornucopia ist bis auf einen hellen Saum entlang des Randes und den rötlichen Hornsaum am Operculum an der Unterseite völlig schwarz.
Die Art hat 2 Chromosomen mehr als Neritina violacea.
Heimat:
Das Verbreitungsgebiet umfasst Indien, Südostasien, Neuguinea, die Salomon-Inseln und die Fidschis.
Kennzeichen:
Das Gehäuse ist 1,5 - 2 cm lang, 1,2 - 1,7 cm breit und 0,6 - 1,1 cm hoch.
Es ist schwarz und hat manchmal mehr und manchmal weniger weiße Flecken.
Die Kolumellar-Region und die Mündung sind gelblich, orange bis rot.
Das Operculum ist orange und grau mit einem dunklen Nukleus.
Die Innenseite ist orange-braun. Die Rippe ist am oberen Grad lachsfarben und an der Seite bis zum Rand des Operculums hinunter schwarz.
Der kleine Zapfen ist orange-braun. Am Rand hat der Deckel einen orange-roten Hornsaum.
Die Eikokons sind etwa 1,5 mm lang und einen viertel Millimeter hoch. Sie enthalten jeweils 40 bis 60 Larven.
Ökologie:
Die Neritina violacea lebt in Singapur in den inneren Mangroven auf Steine, Schlamm und abgestorbenem Pflanzenmaterial.
Als innere Mangroven wird die Zone bezeichnet, die oberhalb der Flutlinie liegt und nicht im Rhythmus der Gezeiten vom Meerwasser überflutet wird.
Das Wasser ist brackig, aber nicht so stark salzhaltig wie Meerwasser. Die Wassertemperatur liegt hier zwischen 26 und 32 °C, mit einem Mittel um 29 °C.
In Indien findet man die Schnecken im Coleroon River, etwa 7 Meilen oberhalb der Mündung in den Golf von Bengalen.
Der Salzgehalt des Wassers schwankt im Jahresverlauf zwischen 0,5 und 6 Promille. Die Wassertemperatur liegt zwischen 27,5 und 34,5 °C. Die Tiere leben dort auf Hartsubstraten.
Haltung:
Sehr pflegeleicht und gut zuhalten. Das Wasser verlassen die Tiere in der Regel nicht. Es werden Algenaufwuchs und Fischfutterreste gefressen.


Ihren deutschen Namen hat die Art vom "Cajo-Lago", einem See auf Kuba. Von dort wurde sie vor einigen Jahren von einem Aquarianer mit nach Deutschland gebracht.
Da die Tiere sowohl in Flüssen als auch im Meer leben und dabei farblich sehr variabel sind, gibt es sehr viele Synonyme für diese Art.
Bezeichnend ist, dass sowohl RÖding 1798 als auch MÖrch 1852 diese Art jeweils unter zwei verschiedenen Namen beschrieben haben.
Recluz wollte sie 1850 sogar in drei Arten unterteilen. Gültig, weil am ältesten, ist die Artbezeichnung "virginea" von Linné aus dem Jahre 1758.
Einige Synonyme für Neritina virginea:
Neritina braziliana Sowerby, 1849
Neritina matoni MÖrch, 1852,
Neritina trabalis MÖrch, 1852
Neritina cajennensis Rigacci, 1866
Neritina minor Metcalf, 1904
Nerita virginea Linné, 1758
Nerita cardinalis RÖding, 1798
Nerita nigrocincta RÖding, 1798
Nerita chlorina Link, 1807
Nerita phrygia Dillwyn, 1823
Nerita listeri Pfeiffer, 1840
Nerita bahiensis Recluz, 1850
Nerita fasciola Recluz, 1850
Nerita tigris Recluz, 1850
Handelsbezeichnungen:
Cajo-Lago-Schnecke
Heimat:
Diese Schnecke kommt an den tropischen Küsten Mittelamerikas und Südamerikas vor. Man findet sie von Florida bis Brasilien.
Das Verbreitungsgebiet der Cajo-Lago Schnecke reicht laut Western Atlantic Gastropod Database von 32.3°N bis 27°S und 97.7°W bis 35°W.
Die Tiere leben in Flüssen und an der Küste von Florida, Texas, Mexico, Guatemala, Costa Rica, Panama, Kolumbien, Venezuela,
auf den Bermudas, den Bahamas, Kuba, den Cayman Inseln, Jamaica, den Jungfraueninseln, in der Dominikanische Republik, Surinam und Brasilien.
Kennzeichen:
Das Gehäuse ist maximal 1,3 cm lang, halbkugelig, fest glatt und glänzend.
Es hat ein Muster aus Linien, Strichen und Punkten auf. Die Farbpalette reicht von gelb über orange-braun und rot bis schwarz.
Farbanteile und die Verteilung auf die Muster ist sehr variabel.
Oft findet man einen Wechsel aus hellen und dunkleren Spiralbändern, innerhalb deren sich kleinere helle oder dunkle Striche oder Punkte befinden.
Die Kolumellar-Fläche ist weißlich bis gelblich.
Ökologie:
Die Schnecke lebt in der Gezeitenzone auf der Ufervegetation und auf Schlamm, ist aber auch im Süßwasser zu finden.
Besonders während Regenperioden wandern die Jungtiere in großen Massen von bis zu 3000 Tieren pro Quadratmeter die Flüsse hinauf.
Die gelblichen Eikokons werden auf Hartsubstraten und anderen Schnecken abgelegt.
Nach dem Schlupf werden die Larven mit dem Flusswasser in die Brackwasserzonen der Flussmündungen,
die als ästuare bezeichnet werden, gespült. Sie entwickeln sich hier zu kriechenden Schnecken und wandern langsam die Flüsse
hinauf, während sie heranwachsen.
Daher werden flussaufwärts immer größere Tiere gefunden, als in Mündungsnähe und im Küstenbereich.
Auf den Bahamas leben die jungen Tiere auf Sandflächen und an Seegras.
Sie werden von Fischen (z.B. Lutjanus apodus und Halmolon sciurus)
gefressen.Die Schnecke wird von Fischen, Vögeln und Krustentieren gefressen.
Haltung
Sie lebt problemlos mehrere Jahre im Aquarium.
Je nach Herkunft können die Tiere im Süßwasser oder im Riffaquarium gehalten werden.
Die Art ist auch unter dem Synonym Nertina communis bekannt. Sie kommt auf den Philippinen und im West-Pazifik vor.
Sie lebt auf Schlammflächen in Mangroven und im gezeitenbeeinflussten Mündungsbereich von Flüssen im Brackwasser (Encyclopedia of Life).
Kennzeichen:
Typisch ist ein Muster aus Spiralstreifen. Die Gehäuse sind farbenfroh in kräftigen Rot- und OrangetÖnen mit schwarzem Linienmuster.
Sie sind etwa 1,5 bis 2 cm lang.
Bei Lifedesks.org
ist ein Foto von einem Gehäuse und dem Deckel zu sehen.
Anmerkungen:
Sie werden manchmal in Riffaquarien gehalten (Saltcorner).
Als Tiere für das Süßwasseraquarium sind sie bei uns neu. Ein Haltung soll problemlos möglich sein.
Eine UmgewÖhnung von Salzwasser auf Süßwasser ist aber nicht möglich.
Die Schnecke weidet Algen von harten Substraten. Bei Nahrungsmangel oder Störung durch andere Tiere versucht sie das Aquarium zu verlassen.
In der Gattung gibt es mindestens vier Arten. Die Tiere gehören nicht zu den typischen Aquarientieren.
Sie wurden aber mehrmals als Neritina spec. importiert.
Charakteristisch ist das Fehlen eines Hornrandes am Operculum.
Die Rippe ist gefurcht und zur Spitze hin fächerartig verbreitert.
Der Kegel wächst aus dem Rand der Rippe. Darunter ist das Operculum tief ausgehÖhlt. Am Rand der Kolumellaris gibt es keine Zähne.

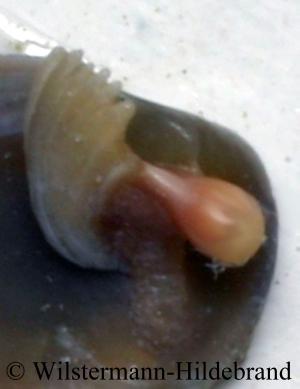
Handelsbezeichnungen:
keine
Heimat:
Malaysia, Philippinen, Salomonen, Neu Kaledonien
Kennzeichen:
Das Gehäuse ist bis 2,6 cm lang. Es ist schwarz mit weißen oder gelblichen Punkten und Linien.
Auf der Oberfläche sind feine Längsrillen. Die Kolumellar-Region ist weiß und hat am oberen Rand eine schwarze Linie.
Die Mündungslippe ist weiß. Das Operculum ist schwarz oder bräunlich.
Die Rippe ist abgeflacht und zur Spitze hin fächerartig gefurcht und verbreitert.
Der Zapfen hat die Form eines schmalen Stiels mit einem kugeligen Kopf. Er geht aus dem Rand der Rippe hervor.
Darunter ist eine große, tiefe AushÖhlung im Operculum.
Ökologie:
Diese Schnecke lebt in Brackwasser von Mangroven und in Flüssen.
Die Wassertemperatur liegt um etwa 25 °C und der ph-Wert um 7.
Auf den Philippinen lebt die Art in Flüssen in denen auch der Hammerschlag Wasserkelch (Cryptocoryne aponogetifolia) vorkommt.
Einige Tiere reisten von dort als blinde Passagiere an den Pflanzen mit nach Deutschland.
Haltung:
Die Tiere lebten etwa 1 Jahr in meinem Aquarium. Sie verließen das Wasser nie. Die Lebensansprüche entsprechen denen von Neritina- und Clithon-Arten.


Handelsbezeichnungen:
Batikschnecke
Als Batikschnecke wird auch Neritina variegata angeboten.
Heimat:
Philippinen

Kennzeichen:
Das Gehäuse etwa 2,0 cm lang, 1,6 cm breit und 1,2 cm hoch.
Außen ist es weiß oder hellbraun bis schwarz mit schwarzen oder braunen Linien oder einem dunklen Netzmuster.
Auf der Oberfläche sind feine Längsrillen sichtbar.
Die Kolumellar-Region ist weiß bis grau und hat am oberen Rand einen rotbraunen oder schwarzen länglichen Fleck.
Die Mündungslippe ist weiß bis gelblich. Das Operculum ist außen cremefarben, bräunlich bis schwarz. Innen ist es rotbraun.
Die Rippe ist abgeflacht und zur Spitze hin fächerartig verbreitert. Sie hat vier Furchen.
Der Zapfen wächst aus einer breiten Basis hervor. über seine gesamte Länge bleibt er im Durchmesser gleich.
Das Ende ist abgerundet. An der Unterseite des Zapfens setzt eine flache Wand an, die ihn mit dem Zentrum einer Vertiefung verbindet.
Ökologie:
Diese Schnecke lebt in Brack- und Süßwasser.
Sie sitzen unter und über Wasser nahe der Wasserlinie auf Felsen. Man findet sie auch auf Bäumen in der Nähe von Flüssen.
Haltung:
Die Tiere scheinen besonders empfindlich auf Kupfer im Leitungswasser zu reagieren.
Ich hatte nach Wasserwechseln Ausfälle, wenn ich keinen Wasseraufbereiter verwendet habe.
Bei Neritina-Arten gab es diese Probleme nicht.
Die Schnecke wird mit Neritina variegata verwechselt. Bei Bitter (2008)
ist diese als Vittina variegata bezeichnet. Sie hat im gegensatz zu Neritodryas dubia ein glattes Gehäuse ohne die Spiralfurchen. Außerdem hat sie eine gezähnte Kolumellarlippe.




Charakteristisch für die 13 Septaria-Arten ist ein dünnes, glattes, flaches und symmetrisches Gehäuse.
Das Operculum ist in den Fuß eingewachsen. Das Tier kann damit die Gehäusemündung nicht verschließen.
Der Kolummellar-Bereich ist auf ein schmales Septum am hinteren Schalenende reduziert.
Bei Septaria suffreni gibt es einen Sexualdimorphismus. Bei den männlichen Tieren ist in der
Mitte das Septum zungenförmig ausgezogen und bei den Weibchen nicht.
Bei Septaria porcellana und Septaria bougainvillei sind die Männchen deutlich
kleiner als die Weibchen. S. macrocephala ist nach Ansicht von Haynes (2001b) ein protandrischer Konsekutivzwitter.
Sie schließt das daraus, dass sie keine Männchen finden konnte, die größer waren als 16 mm und keine Weibchen die kleiner waren als 10 mm. Die
schlüpfenden Tiere sind alle männlich. Zwischen zwei Paarungssaisons beginnen die Tiere ab einer Schalenlänge von 10 bis 15 mm Eier zu produzieren.
Einige Arten übertragen bei der Paarung Spermatophoren und andere Spermien.
1975 versuchten Golikov & Starobogatov für die Gattung Septaria die Familie der Septariidae einzuführen,
die aber nie allgemeine Anerkennung fand. Holthuis (1997) machte eine umfangreiche phylogenetische Analyse und kam zu dem Schluss, dass die Unterschiede
zwischen Septaria und Neritina nicht ausreichen, um Septaria in eine eigene Familie zu stellen.
Dieses Ergebnis wurde von Haynes (2005) in ihrer Revision der Gattung bestätigt. Septaria ist also wie Neritina
und Clithon eine eigenständige Gattung der Neritidae.
Das Verbereitungsgebiet umfasst die Fidschi-Inseln, Samoa, Vanuatu, die Salomonen, FranzÖsisch Polynesien, Neuguinea, Guam, die Philippinen und reicht im Westen bis zu den Seychellen.
Diese Art wird als die Muschel- oder Algenschnecke zum Kauf angeboten.
Sie ist sehr empfindlich und sollte nicht gekauft werden. Die Tiere leiden beim Transport sehr und haben eine sehr hohe Sterblichkeit.
Sie vertragen es gar nicht gewaltsam vom Substrat gelöst zu werden und freiwillig lassen sie nicht los. Ihr Gewebe reist leicht, was ihren Tod bedeutet.
Handelsbezeichnungen:
Muschelschnecke, Algen-Rennschnecke, Süßwassernapfschnecke
Heimat:
Indien, Indonesien, Taiwan, Japan,, Philippinen, Palau, Guam, Ponepe, Truk, Salomonen, Vanuatu, Neu-Kaledonien, Fiji, Samoa, Tahiti, Neu Guinea und Nordaustralien
Kennzeichen:
Das Gehäuse ist symmetrisch, flach und 1 - 2,7 cm lang, 0,8 - 2 cm breit und 0,6 - 0,8 mm hoch.
Das Verhältnis von Breite zur Länge liegt bei durchschnittlich 0,79.
Der Apex ragt über den hinteren Gehäuserand hinaus. Die Grundfarbe ist gelb-braun.
Darauf ist ein variables Muster aus feinen schwarzen oder rötlichen Linien.
Das Septum ist schmal, am Rand gelblich und gebogen. Das Operculum ist annähernd quadratisch, hell rosa mit einer relativ langen Rippe und einem gelb-orangen Hornrand.
Der Weichkörper ist weißlich, gelblich oder cremefarben mit einem feinen, grauen Fleckenmuster.
Ökologie:
Die Tiere kommen von den Gezeiten beeinflussten Brackwasser führenden Bereichen der Flussmündungen bis etwa 5 oder 6 Kilometer die Flüsse hinauf vor.
Man findet sie im Binnenland in schnell strömenden Flussabschnitten (Stromschnellen, Kaskaden).
Die Schnecken sitzen auf Felsen und weiden Algenaufwuchs ab.
Wasserwerte in Habitaten von Septaria porcellana (nach Starmühlner 1993 und Haynes 1990)
| Fundort | Tonga und Samoa | New Georgia | Savai´i | Tutuila | Upolo |
|---|---|---|---|---|---|
| Temp. [°C] | 26,5 | 25-26 | 25 | 27 - 30 | 26 |
| pH-Wert | > 6,6 | 6,9-7,1 | 7,1 - 7,2 | 6,4 - 7,3 | 6,6 |
| Leitwert [µS/cm] | 76,2 | 181 - 183 | 57,8 - 103,9 | 146 - 152 | 78,5 |
| CaCO3 [mg/l] | 5,6 * | 21,5 - 22,0 | 11,3 - 26,1 | 15,0 - 33,7 | 20,3 |
| °dGH | 2 | 1,2 * | 0,6 - 1,5 * | 0,8 - 1,9 * | 1,1 * |
* Werte errechnet
Haltung:
Diese Art ist bereits seit einigen Jahren immer wieder im Handel zu bekommen. Sie ist in der Haltung schwierig.
Die Sterblichkeit neu gekaufter Tiere ist sehr hoch.
Vermutlich tragen die Tiere während des Sammelns und beim mehrmaligen Umsetzen bei den verschiedenen Zwischenhändlern Verletzungen durch das Ablösen vom Substrat davon.
Nicht alle Individuen scheinen im Aquarium Ersatznahrung anzunehmen und die Meisten sterben innerhalb weniger Wochen.
Ich habe aber einzelne Exemplare bis zu 3 Jahre lang in Aquarien zusammen mit Apfelschnecken und Neritina-Arten gehalten, ohne dass in diesen Becken nennenswerter Algenaufwuchs war.
Vermutlich fressen die Tiere nachts auch Detritus und Futterreste.
Die überlebenschancen von Septaria porcellana liegen unter 1%. Darum sollte man im Interesse der Tiere darauf verzichten, sie zu kaufen, damit sie nicht mehr gesammelt werden.


Handelsbezeichnungen:
Muschelschnecke. Diese Schnecke wurde als S. porcellana importiert und verkauft.
Heimat:
Indien, Sri Lanka, Taiwan, Philippinen, Indonesien, Guam, Truk, Ponepe, New Georgia, Fidschii, Tahiti
Kennzeichen:
Das ovale Gehäuse ist 1,2 - 27 mm lang, 6 - 14 mm breit und 2 - 6 mm hoch.
Es gibt zwei Gehäuseformen. Eine weite Form mit einem durchschnittlichen Verhältnis von Breite zur Länge von 0,67 und eine schmale Form mit einem Breiten-Längen-Verhältnis von 0,45.
Der Apex ragt nicht über den hinteren Rand des Gehäuses hinaus.
Die Grundfarbe ist gelb-braun oder gelbgrün gezeichnet mit schwarzen oder roten geraden, geschwungenen oder gezackten Linien.
Bei der schmalen Form treten auch zum Vorderrand hin breiter werdende Längsstreifen auf. Das Septum ist recht breit und hat einen geschwungenen Rand.
Das Operculum ist weiß bis hellgelb. Es ist länglich, hat eine nach innen gebogene Rippe und einen transparenten Hornrand. Bei der schmalen Form ist es entsprechend schmaler.
Das Männchen hat einen relativ langen dünnen Penis mit einer langen Papille.
Ökologie:
Die Tiere leben im Brackwasser von Flussmündungen und in von den Gezeiten beeinflussten Unterläufen von Flüssen.
Die breite Form findet man auf Steinen in schnell fließendem Wasser. Die schmale Form lebt auf den Stängeln von Gräsern, Schilf und Bambus im ruhigen Wasser.
Im Vellar und Coleroon ästuar an der Küste von Indien leben die Tiere etwa 7 Meilen von der Mündung in den Golf von Bengalen entfernt auf Steinen.
Der Wasserstand schwankt im Gezeitenrhythmus etwa 15 bis 23 cm. Der Salzgehalt reicht von 0,5 bis 6 Promille (0,5 bis 6 g/l).
Die Wassertemperaturen betragen 27,5 - 34,5 °C. Die Tiere sitzen in Gruppen direkt unter der Wasserlinie.
Die breite Form findet man auf Steinen in schnell fließendem Wasser.
Die schmale Form lebt auf den Stängeln von Gräsern im ruhigen Brackwasser.
Die Tiere scheinen nicht dauerhaft in reinem Süßwasser zu leben.
Haltung:
Die Tiere überleben im Süßwasseraquarium nicht.
Sie sterben innerhalb weniger Tage oder Wochen. über Haltung in Brackwasserbecken ist nichts bekannt.
Septaria lineata ist ein Synonym dieser Art.
Bei der "Septaria lineata" die Chatterjee et al. (2008) beschreiben handelt es sich nicht um eine Neritidae,
sondern wahrscheinlich um eine Süßwassernapfschnecke aus der Familie der Ancylidae (Ferrissia), die falsch bestimmt worden ist.
Es gibt etwa 20 rezente Arten in der Gattung und etwa 140 fossile Formen. Theodoxus - Arten unterscheidet sich von den übrigen Neritidae dadurch, dass sie ihre Entwicklung zur fertigen Schnecke innerhalb des Eikokons abschließen. Sie haben keine freischwimmenden Veliger. Dieses Larvenstadium durchlaufen sie im Kokon. In jedem Eikokon entwickelt sich nur eine (selten bis drei) kleine Jungschnecke, der 50 bis 150 unbefruchtete Eier als Nahrung dienen. Die Jungtiere schlüpfen nach etwa 2 Monaten. Die Tiere leben etwa 2 bis 4 Jahre. Die Zahl der Nachkommen bei Theodoxus deutlich geringer als bei anderen Neritidae. Dafür sind die Jungschnecken durch die Entwicklung im Kokon besser geschützt und haben eine größere individuelle überlebenschance. Die Tiere können auf diese Weise auch Gewässer besiedeln, die keinen direkten Zugang zum Meer haben. Der Lebensraum der Tiere ist aber nicht auf das Süßwasser begrenzt. Man findet sie unter anderem auch in der Ostsee (Th. fluviatilis) und dem Kaspischen Meer (Theodoxus schultzii). In Deutschland leben außer Theodoxus fluviatilis noch Theodoxus transversalis und Theodoxus danubialis.


Handelsbezeichnungen:
Die Tiere sind nicht im Handel zu finden. Lediglich über Onlineforen oder private TauschbÖrsen kann man Tiere aus Aquarienpopulationen erhalten.
Sie werden als Kahnschnecke oder Schwimmschnecke bezeichnet.
Heimat:
Theodoxus fluviatilis ist die Art mit dem grÖßten Verbreitungsgebiet in der Gattung.
Es umfasst Südschweden, Südfinnland, Estland, Lettland, Litauen, Polen, Ungarn, Slowakei, Dänemark, England, Irland, Niederlande, Belgien, Luxemburg, Schweiz, Österreich.
In Deutschland war sie ursprünglich in allen großen Flusssystemen verbreitet.
Heute findet man die Tiere vor allem in Schleswig-Holstein und Mecklenburg-Vorpommern und vereinzelt entlang von Rhein, Main, Mosel, Neckar und Weser.
Kennzeichen:
Das halbkugelige Gehäuse ist bis zu 12 mm lang, 7 mm breit und 4 mm hoch. Es hat eine glatte Oberfläche.
Die Farbe variiert von weiß mit schwarzer oder rötlicher Zeichnung bis hin zu schwarz mit wenigen weißlichen oder gelben Aufhellungen.
Die Kolumellar-Fläche ist weiß. Das Operculum hat eine schlanke, weiße Rippe. Der Zapfen stark reduziert.
Im Brackwasser der Ostsee bleiben die Tiere kleiner. Sie erreichen nur eine Schalenlänge von 5-6 mm.
Das Größe bisher gefundene Exemplar war 9,6 mm lang. Das grÖßte Gehäuse aus dem Süßwasser war 13,6 mm lang.
Mittlerweile haben mehrere morphologische und genetische Untersuchungen gezeigt, dass es keine Unterschiede zwischen den Tieren im Süß- und Brackwasser gibt.
Daher ist die Unterscheidung der Formen als Unterarten nicht sinnvoll.
Ökologie:
Theodoxus fluviatiles hält sich nicht bevorzugt in sauerstoffreicheren Gewässerabschnitten auf.
Die Tiere leben zum Teil in Gewässerabschnitten, die im Sommer weniger als 2 mg/l Sauerstoff enthalten.
Ausschlaggebend scheint für die Besiedelung das Nahrungsangebot zu sein. Wo sie vorkommen, findet man sie meist in großen Mengen.
Man findet sie bei Salzgehalten von 2,5 bis 15 Promille. In Süßwasser bevorzugt sie als Substrat Steine und Holz. An den Küsten lebt sie vor allem auf Blasentang und Seegras.
Die Eiablage erfolgt von April bis etwa Anfang Oktober.
Die Eikokons im Süßwasser sind etwa 0,8 - 1,2 mm lang. Jede Kapsel enthält ein bis drei befruchtetet Ei und 50 bis 150 Nähreier.
Im Brackwasser sind sie 0,6 - 0,9 mm lang und enthalten nur 50 bis 80 Eier. Die Kokons werden auf Steinen oder den Gehäusen anderer Schnecken abgelegt.
In der Ostsee wird auch gerne der Blasentang (Fucus) als Laichsubstrat benutzt. Mit ihm können die Gelege verdriften, was zur Ausbreitung der Art beiträgt.
Die Entwicklung bis zum Schlupf dauert bei 25 °C etwa 30 Tage. Bei 20 °C schlüpfen die 0,5 bis 1 mm großen Jungschnecken erst nach 65 Tagen.
Eutrophierung der Gewässer drängt die Schnecken zurück. Vermutlich ist dafür die Veränderung im Nahrungsspektrum verantwortlich.
Haltung:
Diese kleinen Schnecke kann man recht gut im Aquarium halten und sie vermehrt sich auch.
Wichtig ist es dass sie raue Oberflächen zur Verfügung haben auf denen sie ihre Nahrung zerreiben können.
Theodoxus fluviatilis lässt sich nicht dauerhaft nur auf Pflanzen und Glas halten. Holz und Steine sind wichtig.
Als Nahrung dienen Algen, Schwämme und Futterreste. Sie pflanzen sich unter günstigen Lebensbedingungen auch im Aquarium fort.
Anmerkungen:
Die Tiere sind geschützt und dürfen nicht aus der Natur entnommen werden.
In Deutschland sind sie stark gefährdet in der Schweiz vom Aussterben bedroht und in der Tschechischen Republik sind sie bereits ausgestorben.
Mit zunehmend verbesserter Wasserqualität wird diese Art in Europa wieder häufiger.
Sie ist Indikator für gering belastete Gewässer (Güteklasse I-II). Sie steht in Deutschland auf der Roten Liste der vom Aussterben bedrohten Tiere.
Diese Schnecke war 2004 das Weichtier des Jahres.

Verwendete und weiterführende Literatur:
K. Bandel & Kiel, St. (2003): Relationships of Cretaceous Neritimorpha (Gastropoda, Mollusca), with the description of seven new species.- Bulletin of the Czech Geological Survey, Vol. 78, No. 1, 53-65
J. Barsiene, G. Tapia, A. M. Pujante, A. Martinez-Orti (2000): A comperative study of chromosomes in four species of Theodoxus (Gastropoda: Neritidae).- J. Moll. Stud. 66, 535-541
S. Bergleiter (1997): "Süßwasser-Napfschnecken" im Aquarium.- DATZ 10/97, 680-681
J. Blanco, F.N. Scatena (2005): Floods, Habitat Hydraulics and Upstream Migration of Neritina virginea (Gastropoda: Neritidae) in Northeastern Puerto Rico.- Caribbean Journal of Science, Vol. 41, No. 1, 55-74
J. F. Blanco-Libreros, A. Arroyave-Rincón (2009): Predator damage and shell size on the diadromous snail Neritina virginea (Gastropoda: Neritidae) in the Mameyes River, Puerto Rico.- Rev. Biol Trop. 57(4), 1069-1080 (Abstract)
P. Bouchet, J.-P. Rocroi (2005): Classification ans Nomenclator of Gastropod Families.- Malacologia 47(1-2), 1-397
D. S. Brown (1994): Freshwater Snails of Africa and their Medical Importance.- 2. Auflage, Taylor & Francis. London
F. Bitter (2008): Schnecken-Fibel - Attraktive und nützliche Tiere im Aquarium.-Dähne-Verlag, Ettlingen
A. Chatterjee, M. Jain, U. S. Roy, S. Kumar Mukhopadhyay (2008): Limnochemical Factors Influencing the Seasonal Population Density, Secondary Production, and Calcium-to-Tissue Ratio in the Freshwater Limpet Septaria lineata (Archaeogastropoda: Neritidae).- Turk Journal of Zool. 32, 245-252
M. D'Souza (1986): The food of some neritid prosobranchia molluscs found at Mkomani Mombasa, Kenya.- Kenya Aquatic Bulletin 3, 46-49
A. Z. Elkarmi, N. S. Ismail (2006): Population Structure and Shell Morphometrics of the Gastropod Theodoxus macri (Neritidae: Prosobranchia) from Azraq Oasis, Jordan Pakistan Journal of Biological Sciences 9(3), 549-552
Gesellschaft Naturforschender Freunde Berlin (1912): Sitzungsberichte der Gesellschaft Naturforschender Freunde zu Berlin 1839 - 1859.- R. Friedländer & Sohn Berlin
P. GlÖer, C. Meier-Brook (2003): Süßwassermollusken.- Deutscher Jugendbund für Naturbeobachtungen, 13. Auflage
K. Govindan, R. Natarajan (1974): Studies of Neritidae (Neritaceae, Prosobranchia) from peninsular India.- Proc. Indian Nat. Sci. Acad. Part B, Biol. Sci. Vol. 38 (3+4), 225 - 239
D. R. Goodwin (2006): The Discovery of Neritina (Theodoxus) cariosa (Wood, 1828) on the Island of Maui (Gastropida: Neritidae).- Visaya Net
A. Haynes (1988): Notes on the stream neritids (Gastropoda; Prosobranchia) of Oceania.- Micronesica Vol. 21, 93-102
A. Haynes (1990): The number of freshwater gastropods on pacific islands and the theory of island biogeography.- Malacologia 31(2), 237-248
A. Haynes (2001 a): Freshwater Snails of the Tropical Pacific Islands.- Institute of Applied Science, Suva, Fiji
A. Haynes (2001 b): A revision of the genus Septaria FERUSSAC, 1803 (Gastropoda: Neritimorpha).- Ann. Naturhist. Museum Wien 103 B, 177-229
A. Haynes (2005): An evaluation of members of the genera Clithon Montfort, 1810 and Neritina Lamarck 1816 (Gastropoda: Neritidae).- Molluscan Research 25(2), 75-84
C. Little (1972): The evolution of kidney function in the Neritaceae (Gastropoda, Prosobranchia).- J. Exp. Biol., 56, 249-261
G. L. Pace (1996): Andrews anatomical studies an their taxonomic significance for the snail family Neritidae.- Proceedings of the sixth symposium on the natural history of the Bahamas, Bahamian Filed Station, San Salvador
C. M. Patterson (1967): Chromosome numbers and systematics in streptoneuran snails.- Malacologia, 5 (2), 111-125
J.R. Post, A. Rastogi, H. L. Vu (2007): No need for speed : A study of the effects of water velocity on Neritina latissima Distribution in an tropical stream.- Dartmouth Studies in Tropical Ecology, Department of Biological Science, Dartmoth College, Hannover, New Hampshire
Qin Huang (1997): Morphological, allozymic, and karyotypic distinctions between Neritina (Dostia) violacea and N. (D.) cornucopia (Gastropoda: Neritoidea).- Journal of Zoology 241 (2), 343-369
L. A. Reeve et al (1856): Conchologia iconica or Illustrations of the shells of molluscous animals.- Vol. 9
W. W. Reynolds, L. J. Reynolds (1977): Zoogeography and predetor-prey ´arms race´. A comparison of Eriphia and Nerita species from three faunal regions.- Hydrobiologia, 56 (1), 63-67
F. Starmühlner (1993): Ergebnisse der Österreichischen Tonga-Samoa Expedition 1985 des Instituts für Zoologie der Universität Wien: Beitrage zur Kenntnis der Süß- und Brackwasser-Gastropoden der Tonga- und Samoa-Inseln (SW-Pazifik).- Ann. Naturhist. Museum Wien 94/95 B 217-306
Y. Takada (2000): Activity Patterns of Clithon oualaniensis (Mollusca: Gastropoda) on intertidal seagrass Beds in hong Kong.- The Marine Flora and Fauna of Hong Kong and Southern China V, 217 - 227
S. K. Tan , R. Clements (2008): Taxonomy and Distribution of the Neritidae (Mollusca: Gastropoda) in Singapore.- Zoological Studies 47(4): 481-494
K. S. Tan, S. S. C. Lee (2009): Neritid egg capsules: are they all that different? - Steenstrupia 30 (2): 115-125
W. Turton, Gray, J. E. (1857). Manual of the land and fresh-water shells of the British Islands: with figures of each of the kinds.- Longman, Brown, Green, Longmans and Roberts in London
G. W. Tyron (1885): Manual of conchology; structural and systematic. With illustrations of the species.- Conchological Section, Academy of Natural Science of Philadelphia
Underwood, A. J. (1975). Comparative studies on the biology of Nerita atramentosa Reeve, Bembicium nanum (Lamarck) and Cellana tramoserica (Sowerby) (Gastropods: Prosobranchia) in S.E. Australia. Journal of Experimental Marine Biology and Ecology. 18, 153-172
M. F. Valdéz (1982): Variations in natural populations of Neritina latissima Broderip in Costa Rica. (Gastropoda: Neritidae).- Anales del Instituto de Ciencias del Mas y Limnología 9(10), 111-120
M. Wilstermann-Hildebrand (2010): Faszinierende Rennschnecken.- Amazonas 29, 66-67
M. Wilstermann-Hildebrand (2010): Rennschnecken bestimmen Teil 1.- Amazonas 31, 64-68
M. Wilstermann-Hildebrand (2010): Rennschnecken bestimmen Teil 2.- Amazonas 32, 60 -65
G. Wium-Andersen (1977): Marine Nerita species from Phuket Island and their Chromosome numbers (Gastropoda: Neritidae).- Phuket Marine Biological Center, Resaearch Bulletin No. 15
Yasunori Kano & Hiroaki Fukumori (2010): Predation on hardest molluscan eggs by confamilial snails (Neritidae) and its potential significance in egg-laying site selection.- Journal of Molluscan Studies, 76 (4), 360-366
M. L. Zettler, J. Frankowski, R. Bochert, M. RÖhner (2004): Morphological and ecological features of Theodoxus fluviatilis (Linneaus, 1758) from baltic brackish water and German freshwater populations.- Journal of Conchology, 38 (3), 305-316
M. L. Zettler (2008): Zur Taxonomie und Verbreitung der Gattung Theodoxus MONTFORT, 1810 in Deutschland. Darstellung historischer und rezenter Daten einschließlich einer Biografie.- Mollusca 26 (1), 13-72

© Wilstermann-Hildebrand 2000 - 2025
Impressum
Datenschutzerklärung