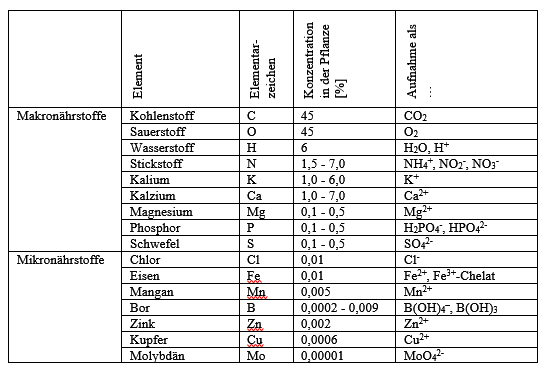
Diese 16 Nährstoffe sind für Pflanzen unverzichtbar.
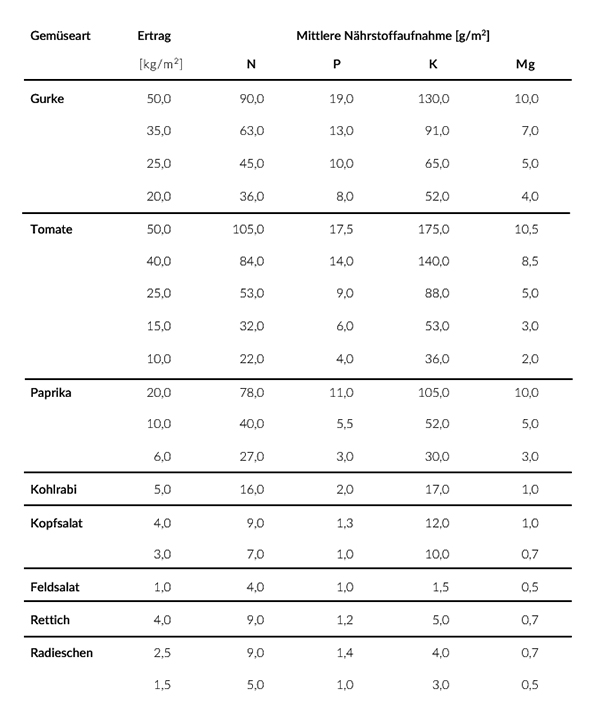
Die Menge der Nährstoffentzüge aus dem Boden hängt von der Pflanzenart ab. Bei einigen Pflanzen (z. B. Gurken, Tomaten) lässt sich der Ertrag steigern, wenn mehr Nährstoffe angeboten werden.

Auf dieser Internetseite erfahrt Ihr alles über Pflanzennährstoffe und Mangelsymptome.
Unabhängig davon, ob sie im Garten, im Teich oder im Aquarium wachsen,
benötigen alle Pflanzen 16 verschiedene Nährstoffe zum Wachsen. Sie brauchen sie als Bausteine für ihre Zellen und für ihren Stoffwechsel.
Fehlen einer oder mehrere Nährstoffe treten Mangelsymptome auf. Typische Symptome sind Verfärbungen (Chlorosen) und das Absterben von Gewebe (Nekrosen).
Solche Symptome können aber auch andere Ursachen haben. Typische Ursachen für Chlorosen und Nekrosen sind:
- akuter Mangel durch das Fehlen eines Nährstoffs
- induzierter Mangel durch Probleme bei der Nährstoffaufnahme
- Konkurrenz der Nährstoffe untereinander
- falscher pH-Wert im Wurzelraum
- falsche Temperatur
- Wurzelschäden durch Pilze, Nematoden oder Sauerstoffmangel
- Überdüngung (Salzschäden)
- Schädlingsbefall (Viren, Insekten, Bakterien)
- Sonnenschäden oder Lichtmangel
- Kälteschäden (Chilling)
- Schäden durch Chemikalien (Algizide, Fischmedikamente, Pflanzenschutzmittel)
- Alterserscheinungen
Pflanzenernährung ist ein sehr komplexes Thema. Der Bedarf an Nährstoffen und die Verhältnisse der verschiedenen Nährstoffe zueinander ist bei verschiedenen Pflanzenarten unterschiedlich.
Es ist möglich, dass eine Art Mangelsymptome zeigt, während eine andere Pflanzenart gesund wächst.
Zusätzlich beeinflussen sich die Nährstoffe gegenseitig, so dass ein Überangebot an einem Nährstoff einen Mangel an einem anderen auslösen kann.
Besonders schwierig wird es, wenn an der Nährstoffaufnahme Symbionten wie Mykorrhizza oder Knöllchenbakterien beteiligt sind.
Dann wirken sich Mangel und Überangebot auch indirekt durch die Beeinflussung der Symbiosepartner aus.
Beispielsweise kann Kalzium-Mangel bei Leguminosen (Erbsen und Bohnen) die Bildung von Wurzelknöllchen behindern und so bei den Pflanzen Stickstoffmangelsymptome auslösen.
Ungünstige pH-Werte, Wurzelschäden oder Sauerstoffmangel im Substrat können die Nährstoffaufnahme erschweren.
Im Garten sind darum Bodenanalysen und im Aquarium Wasseranalysen für die Identifikation von Kulturprobleme unverzichtbar.
Krankheiten und Schädlinge (Wurzelfäule, Gemüsefliegen) können die Wurzeln schädigen und so die Nährstoffaufnahme beeinflussen.
Pilzkrankheiten und Viren an den Blättern Verfärbungen und das Absterben von Gewebe verursachen, so dass sie vor einer Düngung als Ursache der Symptome ausgeschlossen werden müssen.
Bei der Beurteilung von Mangelsymptomen an Pflanzen müssen darum immer alle Umweltfaktoren berücksichtigt werden.
Konkrete Düngeempfehlungen kann und will ich Euch hier nicht geben. Wieviel Ihr düngen müsst hängt zum einen davon ab,
welche Nährstoffe bereits im Boden oder im Aquarienwasser enthalten sind und zum anderen welche Pflanzen Ihr pflegt.
Düngeempfehlungen für Euren Garten erhaltet Ihr, wenn Ihr Bodenproben in ein entsprechendes Institut zur Analyse schickt.
Richtwerte für Nährstoffgehalte im Aquarienwasser findet Ihr hier.


Pflanzennährstoffe sind Mineralstoffe, die für die Pflanze unverzichtbar sind.
Um als Pflanzennährstoff zu gelten, muss ein Mineralstoff folgende Kriterien erfüllen:
- Ohne ihn ist ein normales Wachstum und die Reproduktion nicht möglich.
- Er ist in seiner Funktion nicht durch einen anderen Mineralstoff ersetzbar.
- Er nimmt direkt oder indirekt an Stoffwechselprozessen teil.
Die verschiedenen Nährstoffe haben unterschiedliche Aufgaben in den Zellen und können in ihrer Funktion nicht durch andere chemische Elemente ersetzt werden.
Darum gibt es keine wichtigen und unwichtigen Nährstoffe. Nur wenn alle Nährstoffe im richtigen Verhältnis vorliegen, bleiben die Pflanzen gesund.
Zusätzlich zu den Nährstoffen gibt es noch die sogenannten "Beneficial Elements".
Das sind Mineralstoffe, die bei einigen Pflanzen das Wachstum, die Keimung oder die Widerstandskraft verbessern, deren Fehlen aber nicht zu Mangelsymptomen führt.
Diese Elemente sind Aluminium (Al), Kobalt (Co), Nickel (Ni), Natrium (Na), Selen (Se) und Silizium (Si).
Um die Bedeutung der Nährstoffzusammensetzung im Wasser für die Pflanzen und die daraus resultierenden Wechselwirkungen der Nährstoffe miteinander zu verstehen,
solltet ihr den folgenden Absatz lesen. Die darin verwendeten Fachbegriffe findet Ihr alle in den drei Grafiken in diesem Abschnitt wieder.
Die Wurzel ist wie ein Zylinder geformt. Ganz innen liegen die Leitgefäße.
Das Xylem (blau dargestellt) transportiert Wasser von der Wurzel nach oben in den Spross und die Blätter.
Durch die Verdunstung über die Blätter entsteht ein Sog, der ständig Wasser aus dem Boden zur Wurzel fließen lässt (Transpirationsstrom).
Mit dieser Strömung gelangen ständig neue, gelöste Nährstoffe zur Wurzel.
Das Phloem (grün dargestellt) transportiert Eiweiße, Zucker, Pflanzenhormone und andere gelöste Stoffe aus den Blättern und dem Spross in die Wurzeln.
Die Leitgefäße sind von einer Zellschicht umgeben, deren Zellwände für Wasser undurchlässig sind. Diese Zellschicht wird als Endodermis bezeichnet.
Um den Zentralzylinder herum liegt die Wurzelrinde, auch Rindenparanchym genannt. Hier sind die Zellwände für Wasser durchlässig.
Nach außen wird die Wurzelrinde durch die Exodermis begrenzt.
Im Bereich der Wurzelspitzen liegt über der Exodermis noch eine weitere Zellschicht, die als Rhizodermis bezeichnet wird.
Diese kurzlebigen Zellen haben lange, dünne Ausstülpungen, die Wurzelhaare genannt werden (im Schema nicht dargestellt).
Sie vergrößern die Wurzeloberfläche und machen so die Nährstoffaufnahme effektiver.
Die Wurzelhaarzellen sterben aber bereits nach wenigen Tagen ab, während die Wurzel an ihrer Spitze weiter wächst.
Die Zellwände (in der mittleren Grafik grün dargestellt) bestehen aus langen Fasern von Zellulose, die durch Kalzium-Ionen mit einander verkettet sind.
Sie sind flexibel und für Wasser durchlässig. Es gibt Hohlräume zwischen ihnen, in denen sich Wasser und Luft befinden.
Die Zellwände und die Hohlräume bilden zusammen den Apoplasten. Hier finden keine pflanzlichen Stoffwechselprozesse statt.
In den Zellen ist das Cytoplasma.
Das Cytoplasma ist von einer semipermeablen (halbdurchlässigen) Membran umgeben, die als Plasmamembran oder Plasmalemma bezeichnet wird (in der Grafik blau dargestellt).
Das Cytoplasma der benachbarten Zellen ist durch kleine Kanäle (Tüpfel) miteinander verbunden.
Die Gesamtheit des Cytoplasmas in den Zellen wird als Symplast bezeichnet. Hier finden alle Stoffwechselvorgänge statt.
Im Inneren jeder Zelle gibt es eine weitere Membran, den Tonoplasten. Diese Membran umschließt die Vakuole, die ich jetzt einmal den "Wertstoffhof" der Zelle nenne.
In der Vakuole werden alle überschüssigen Nährstoffe und schädliche Verbindungen gelagert. Bei Bedarf können manche Stoffe aus der Vakuole zurück geholt werden. Für andere Stoffe ist die Vakuole die Deponie für die Endlagerung.
Das Ziel der Pflanze ist es nun Nährstoffe mit den Wurzeln aus der wässrigen Bodenlösung oder auch über die Blätter aus dem Teich- oder Aquarienwasser aufzunehmen.
Im Wasser sind die Nährsalze gelöst und liegen als positiv geladenen Kationen (Kat+) oder als negativ geladenen Anionen (An-) vor.
Diese Ionen müssen nun Zellwand und Zellmembran passieren, um in den Zellsaft zu gelangen.
Dabei gibt es zwei Probleme. Moleküle bewegen sich durch Diffusion in wässrigen Lösungen und folgen dabei einem Konzentrationsgefälle.
Sie bewegen sich aus Bereichen mit hoher Konzentration weg in Bereich mit geringerer Konzentration bis sie gleichmäßig in einer Lösung verteilt sind.
In der Pflanzenzelle herrscht aber eine höhere Nährsalz-Konzentration als im Apoplasten.
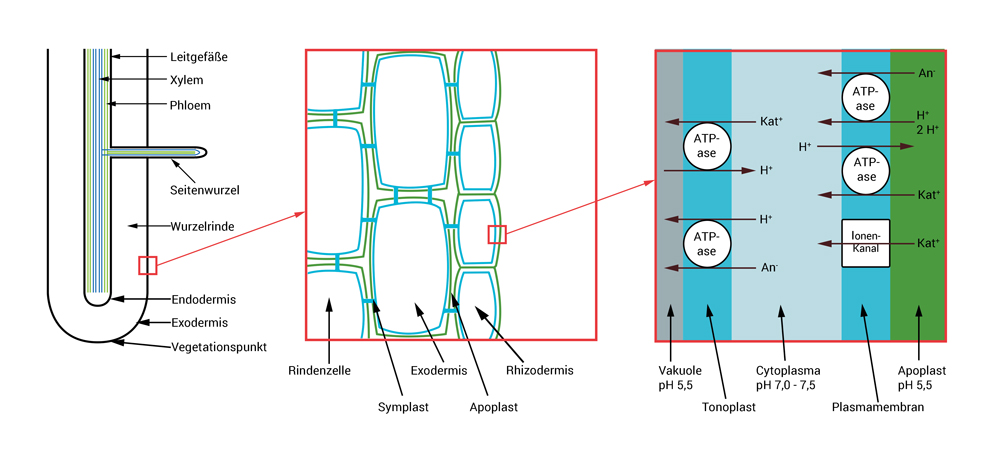
Bei der Nährstoffaufnahme muss die Pflanze die Ionen darum gegen das Konzentrationsgefälle transportieren und gleichzeitig verhindern, dass sie ihr durch Diffusion wieder verloren gehen.
Das zweite Problem besteht darin, dass die Aufnahme der Ionen, die entweder positiv oder negativ geladen sind) sich auf den pH-Wert des Cytoplasmas auswirkt.
Damit aber alle Stoffwechselvorgänge reibungslos laufen können, muss der pH-Wert im Zellinneren ständig zwischen 7,0 und 7,5 bleiben.
Das alles ist möglich, weil die Membranen der Pflanzenzellen von Eiweißen durchzogen sind, die gezielt Ionen nach innen oder nach außen schleusen.
Damit diese funktionieren benötigen sie aber Energie in Form von ATP (Adenosin-Tri-Phosphat).
Das Bodenwasser oder auch das Teich- oder Aquarienwasser dringt ungehindert in den Apoplasten ein und folgt dem Transpirationsstrom in Richtung der Leitgefäße.
Dieser Weg führt aber nur bis zur Endodermis. Dort behindern Zellen mit wasserundurchlässigen Wänden den Wasserstrom.
Lediglich durch spezielle Durchlasszellen gelangt das Wasser in das Xylem.
Auf dem Weg dorthin fließen die Nährstoffe an den Membranen der Zellen entlang. Hier werden sie von Transportern (den Carriern) eingefangen und gebunden.
Es gibt Carrier von einfach geladene Ionen wie Kalium oder Nitrat und Carrier für mehrfach geladenen Ionen wie Kalzium, Magnesium, Mangan und Eisen.
Die Transporter können nicht wählen, welches Ion sie nehmen. Wenn es die richtige Ladung hat, wird es transportiert.
Darum ist es wichtig, dass in der Lösung ein ausgeglichenes Verhältnis zwischen den Nährstoffen besteht.
Ist zum Beispiel viel Kupfer vorhanden (z. B. nach einer Behandlung gegen Algen), dann nehmen die Pflanzen viel Kupfer auf.
Entsprechend weniger werden Kalzium, Magnesium oder Eisen aufgenommen.
Um das Problem mit der Aufrechterhaltung des pH-Werts zu lösen, hat die Pflanze zwei Mechanismen entwickelt.
Sie transportiert für ein negativ geladenes Ion, dass sie aufnimmt, auch ein Proton (positives Wasserstoffion) mit in die Zelle.
Wodurch sich deren Ladungen gegenseitig neutralisieren. Dieser gemeinsame Transport wird als Symport oder Co-Transport bezeichnet.
Nimmt die Zelle ein positiv geladenes Ion auf, schmeißt sie dafür ein Proton aus der Zelle raus.
Dieser Austausch von Ionen wird als Antiport oder Counter-Transport bezeichnet.
Auf die gleiche Weise transportiert die Zelle Ionen in die Vakuole.
Um den pH-Wert dauerhaft aufrecht zu halten gibt es in der Zellwand Protonenpumpen, die ständig mit Hilfe von Energie (ATP) überschüssige Protonen nach draußen befördern (nicht dargestellt).
Darum ist der pH-Wert im Apoplasten und in der Vakuole niedriger (etwa 5,5) als im Cytoplasma.
Eine Besonderheit stellen Ionen-Kanäle dar. Sie lassen nur bestimmte Ionen nach innen oder nach außen durch eine Membran.
Besonders häufig gibt es Kalium-Ionen-Kanäle, die bei allen Pflanzen vorkommen. Kalium ist für die Regulierung des Wasserhaushalts wichtig.
Zum Öffnen der Spaltöffnungen, wird Kalium in die Schließzellen gepumpt, die dann durch Osmose mehr Wasser aufnehmen und anschwellen.
Zum Schließen der Spaltöffnung wird das Kalium wieder ausgeschleust. Das Wasser diffundiert aus den Zellen, sie schwellen ab, die Spaltöffnung schließt sich.
Andere Kanäle transportieren NH4+, Ca2+, Mg2+ oder andere positiv geladene Ionen.
Zum Teil sind solche besonderen Kanäle nur von bestimmten Pflanzenfamilien bekannt.
Die Pflanze kann nur Nährstoffe aufnehmen, die in gelöster Form als Ionen oder als Chelatkomplexe (gebunden an Chelatoren wie EDTA) vorliegen.
Ohne Wasser kann die Pflanze keine Nährstoffe aufnehmen.
Die verschiedenen Ionen und Moleküle reagieren miteinander und können als wasserunlösliche Verbindungen aus der Bodenlösung ausfallen (Z.B. als Kalziumphosphat oder Eisenphosphat).
Dann stehen sie den Pflanzen nicht mehr zur Verfügung. Hierbei spielt der pH-Wert im Wurzelraum eine große Rolle.
Pflanzen können durch die Ausscheidung organischer Säuren, den pH-Wert im Wurzelraum absenken.
Außerdem produzieren sie selbst Chelatoren, um Eisen und andere Nährstoffe verfügbar zu machen.
Pflanzen können Nährstoffe nicht selektiv aufnehmen. Die Zusammensetzung der Nährlösung bestimmt über das Verhältnis, in dem die Nährstoffe zur Pflanzen und auch in die Pflanzen gelangen.
Gleichwertige Ionen konkurrieren um die Aufnahmeplätze an den Zellmembranen. Darum kann ein Überschuß an einem Nährstoff die Aufnahme eines anderen behindern.
Eine Überdüngung mit Eisen kann so zum Beispiel einen Mangel an Mangan verursachen.
Wasserpflanzen nehmen unter Wasser mit den Blätter und Stängeln nach den gleichen Mechanismen Nährstoffe auf.
Auch bei der Blattdüngung von Landpflanzen gelangen die Nährstoffe über die gleichen Transportsysteme durch die Zellmembranen.
Bei über Wasser wachsenden Pflanzen müssen sie aber zunächst die Wachsschicht auf den Blätter durchdringen, um in den Apoplasten zu gelangen.
Dafür sind Netzmittel notwendig.

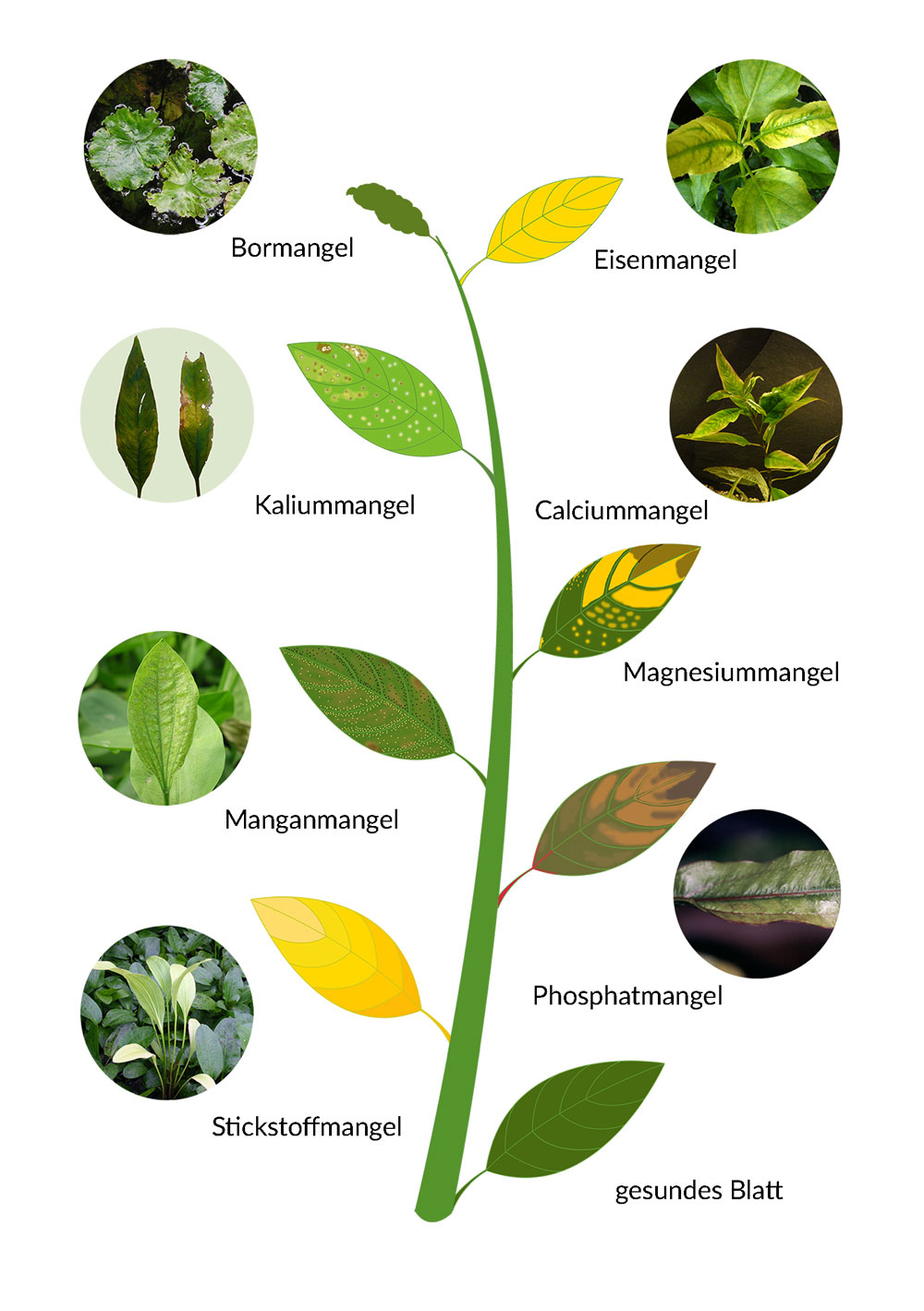
Pflanzen benötigen 16 verschiedene Mineralstoffe um ihre Körpermasse aufzubauen.
Kohlenstoff (C), Wasserstoff (H) und Sauerstoff (O) sind in den größten Mengen in der pflanzlichen Masse enthalten.
Sowohl Zellulose als auch Zucker und Stärke sind aus diesen drei Elementen aufgebaut.
Im Zellkern und in der DNS sind zusätzlich Phosphat (P), Stickstoff (N) und Schwefel (S)enthalten.
Im Zellsaft sind Kalzium (Ca), Kalium (K), Natrium (Na) und Magnesium (Mg) gelöst.
Chlorid (Cl), Bor (B), Eisen (Fe), Mangan (Mn), Zink (Zn),
Kupfer (Cu) und Molybdän (Mo) übernehmen wichtige Aufgaben bei der Aktivierung von Enzymen.
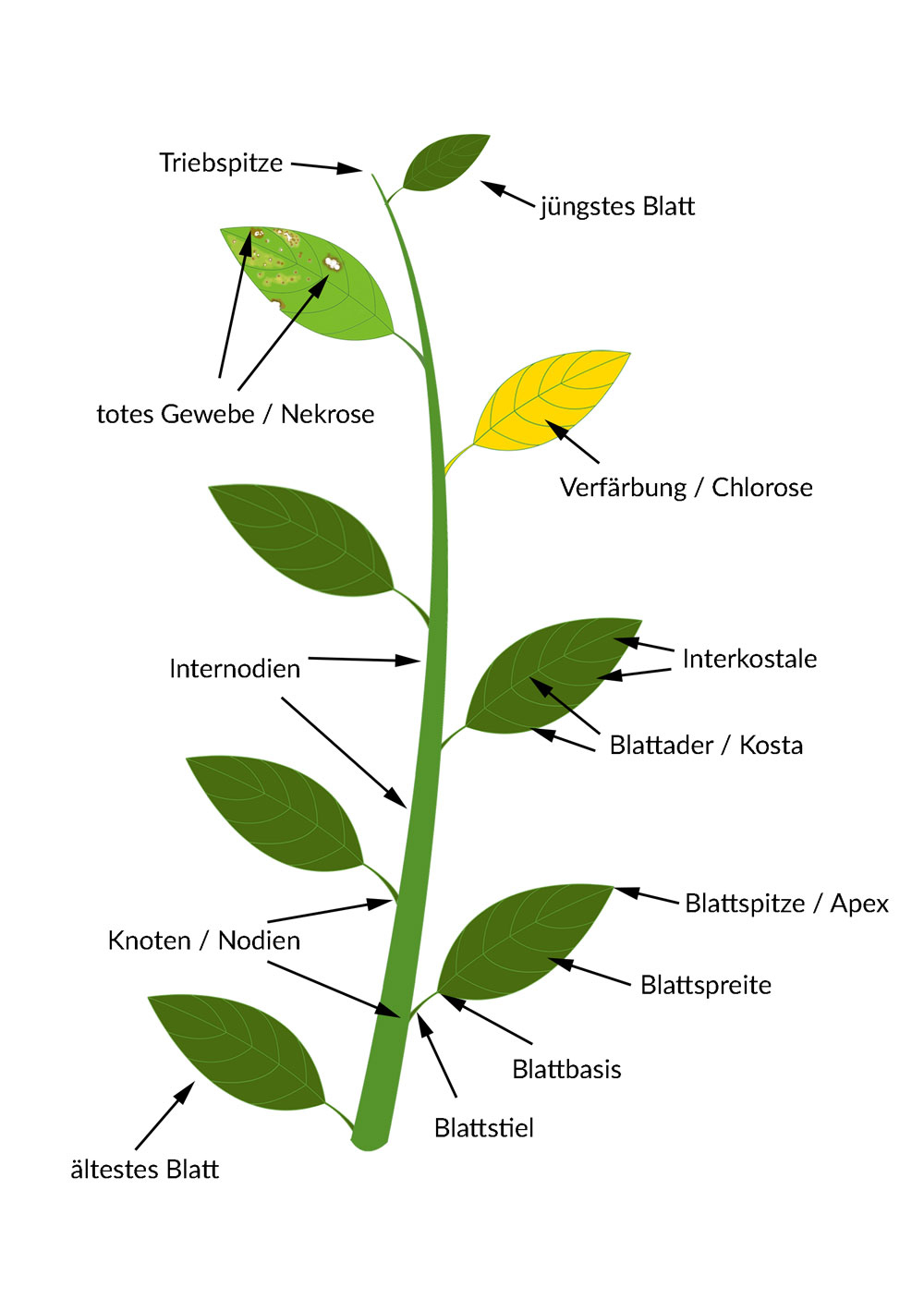
Mangelerscheinungen äußern sich am Häufigsten in Chlorosen (Verfärbung oder Verblassen) und Nekrosen (Absterben von Gewebe).
Wie genau die Mangelsymptome aussehen, hängt von der Pflanzenart und
natürlich vom Nährstoff ab. Eine Chlorose an einer Nordmanntanne sieht anders als die an einem Wasserkelch.
Bei der Frage, welcher Nährstoffmangel in Frage kommt, ist es wichtig zu wissen,
wo an der Pflanzen oder am Blatt die Symptome zuerst aufgetreten sind.
Beispielsweise führt sowohl der Mangel an Stickstoff als auch der Mangel an Eisen zu Gelbfärbung der Blätter.
Stickstoff ist aber ein retranslozierbarer (verlagerbarer) Nährstoff und wird von der Pflanze bei einer Unterversorgung aktiv aus den älteren Blättern in die
Triebspitzen transportiert. Darum werden bei Stickstoffmangel-Pflanzen zuerst die unteren, älteren Blätter gelb.
Eisen ist dagegen nicht retranslozierbar. Es kann nicht wieder aus den Blättern entzogen werden und in der Pflanze weiter transportiert werden.
Darum tritt Eisenmangel immer an neu gebildeten Blättern auf. Man sieht ihn zuerst an den Triebspitzen.
Sowohl die Symptome von Eisen- als auch die von Stickstoffmangel können sich über die gesamte Pflanzen erstrecken.
Man kann bei einer ganz gelben Pflanze die Ursache also nur dann beurteilen, wenn man weiß wo die Chlorose zuerst auftrat.
Wasser- und Bodenproben sind zur Unterstützung einer Diagnose unverzichtbar.
Viren, Pilze und tierische Schädlinge müssen als Ursache von Chlorosen, Nekrosen und Verkrüppelungen ausgeschlossen werden.
Die folgende Liste gibt Hinweise, worum es sich bei den Veränderungen an den Pflanzen handeln könnte.
an allen Pflanzenteilen sichtbare Symptome:
- eigentlich rote oder weiß-panaschierte Pflanzen werden grün; Pflanzen schwächlich; Stängel dünn, bei Rosettenpflanzen Blätter klein; bei Stängelpflanzen lange Internodien, wenig Blätter: Lichtmangel
- Stängelpflanzen lang, unverzweigt: zu hoher Rotanteil in der Beleuchtung
- lange Internodien und kleine Blätter bei Stängelpflanzen; schmächtiger Wuchs bei Rosettenpflanzen: zu hohe Temperaturen im Verhältnis zum Lichtangebot
- Pflanzen kurz und gedrungen: zu hoher Blauanteil in der Beleuchtung
- Blattrandchlorosen, die in Nekrosen übergehen; kleine braune bis schwarze Punkte: Mangantoxizität
- dunkle Flecken, Absterben der Blätter: Phosphatüberschuss
Symptome beginnen an den älteren Blättern:
- hellgrüne bis gelbe Farbe, beginnend an den älteren Blättern, Pflanzen klein, wenige Verzweigungen: Stickstoffmangel
- schmutzig dunkelgrüne bis blaugrüne Farbe, Blattadern und Stängel rötlich, Pflanzen steif (Starrtracht): Phosphatmangel
- Chlorosen in den einzelnen Interkostalfeldern geben dem Blatt ein marmoriertes Aussehen, Blattadern und Blattränder bleiben lange grün, aus den Chlorosen können sich Nekrosen entwickeln: Magnesiummangel
- ausgehend vom Blattrand bilden sich Chlorosen, die in graubraune bis rötlichbraune Nekrosen übergehen: Kaliummangel
- braune oder gelbe Verfärbung, beginnend an den Blattspitzen: Eisentoxizität
Symptome beginnen an den jüngeren Blättern
- in den Interkostalfeldern jüngerer Blätter, mosaikartige Chlorosen, Adern bleiben grün; Übergang
zu größeren gelben Flecken und Nekrosen oder schwarzen Punkten: Manganmangel
- Chlorosen in den Interkostalfeldern jüngerer Blätter: Zinkmangel
- jüngste Blätter klein, verdreht und/oder verkrüppeln: Kalziummangel, Bormangel, Zinkmangel, Kupfermangel
- Junge Blätter sind hellgrün bis zitronengelb oder weiß, Blattadern bleiben zunächst grün; Stängel kürzer und dünner; später auch Blattadern hell; vom Rand beginnend Nekrosen;
kurze, braun verfärbte Wurzeln: Eisenmangel
- jüngste Blätter einschließlich der Blattadern hellgrün bis gelb, Blattadern heller als Blattspreite, gehemmtes Sproßwachstum: Schwefelmangel
- jüngste Blätter zuerst tiefgrün bis blaugrün, später chlorotisch, Absterben zusammen mit der Sproßspitze: Bormangel
- Absterben der Sproßspitze: Kalziummangel, Bormangel, Kupfermangel
Sonstige Symptome:
- Nekrosen an den Blatträndern: Nitrat-Überschuss, z. T durch Molybdänmangel ausgelöst
- Blattspreiten verbogen oder kleiner als normal: Kaliummangel, Molybdänmangel

| % Trockenmasse | |
| Apfel Fruchtfleisch | 0,05 - 0,07 |
| Pontederia cordata Rhizom | 1,08 |
| Potamogeton pectinatus Wurzeln | 1,2 |
| Vallisneria americana Blätter | 1,4 |
| Lagarosiphon major | 1,5 - 1,9 |
| Elodea nuttallii | 1,56 - 2,1 |
| Potamogeton pectinatus Blätter | 1,5 |
| Vallisneria americana Wurzeln | 1,8 |
| Elodea canadensis | 1,83 - 2,1 |
| Nymphoides indica Rhizom | 1,85 |
| Salvinia molesta | 2,08 - 2,37 |
| Nymphaea alba | 2,16 - 2,34 |
| Trapa natans | 2,17 - 3,1 |
| Pontederia cordata Blätter | 2,19 |
| Nymphoides peltata | 2,23 - 3,2 |
| Apfel Blätter | 2,4 - 2,8 |
| Fragaria x annanassa Blatt zur Zeit des Fruchtansatzes | 2,7 - 3,2 |
| Zea mays Kolbenblatt zu Blühbeginn | 2,8 - 3,5 |
| Aponogeton elongatus Blätter bei pH 6,5 | 2,9 |
| Nymphoides indica Blätter | 3,43 |
| Vallisneria natans Blätter | 4,29 |
| Potamogeton mackianus | 4,96 |
| Eichhornia crassipes Blätter | 5,01 |
| Solanum tuberosum Blätter 20 Tage nach der Keimung der Knolle | 6,4 - 6,9 |

Der Mindest-Stickstoff-Anteil an der Trockensubstanz einer ganzen Pflanze liegt bei 1,5%.
Ist der Wert darunter leidet die Pflanze unter Mangel. Meistens ist der Stickstoffgehalt im Pflanzengewebe aber deutlich höher.
Stickstoff wird von Pflanzen als Nitrat, Nitrit und als Harnstoff aufgenommen.
Mit einem steigenden Angebot an Stickstoff, steigt auch der Stickstoffgehalt in der Pflanze. Beispielsweise stieg in einem
Versuch der Anteil von Stickstoff bei Elodea canadensis von 1,83 auf 2,1 % Trockenmasse, bei Elodea nuttalii von 1,56 auf 2,1% und bei Lagarosiphon major
von 1,5 auf 1,9 % bei einer Düngung von jeweils 0,21 mg/l Stickstoff bzw. 3,36 mg/l Stickstoff,
das entspricht einem Äquivalent von ca. 13 bzw. 208 mg Nitrat pro Liter (James et al. 2006).
Der tatsächliche Stickstoffgehalt ist von der Pflanzenart, ihrem Ernährungszustand und dem Alter des untersuchten Pflanzenteil abhängig. Die Tabelle rechts zeigt einige Beispiele.
Stickstoff ist Bestandteil der Erbsubstanz DNS, von Eiweißen, Chlorophyll und verschiedenen Pflanzenhormonen.
Der Stickstoffgehalt in Pflanzen wird aber auch durch andere Faktoren beeinflusst. Bei Vallisneria spinulosa hat sich
in einem Versuch gezeigt, dass durch eine Erhöhung des Kohlendioxid-Angebotes das Wachstum deutlich zunimmt. Überraschenderweise nahm dabei die
Stickstoffkonzentration in den Blättern um rund 15% ab, während
die Wurzeln und Stolonen unbeeinflusst blieben. Die Phosphat-Konzentration
stieg dagegen in den Blättern, Wurzeln und Stolonen um 35 bis 147 % an (Yan X. et al 2006).
Stickstoffmangel ist im Garten und in der Landwirtschaft ein großes Problem. Im Aquarium oder Gartenteich tritt Stickstoffmangel eher selten auf.
Stickstoff gehört zu den verlagerbaren Nährstoffen. Das heißt die Pflanze ist in der Lage Stickstoff aus altem Gewebe
zu mobilisieren und in jüngeres Gewebe zu transportieren.
Zu dieser Verlagerung kommt es auch, wenn die Blätter altern oder abgeworfen werden sollen.
Das passiert zum Beispiel, wenn im Blätter von Laubbäumen ihre Herbstfärbung bekommen.
Es werden Nährstoffe aus den Blättern entzogen und im Stamm gespeichert, um den Nährstoffverlust beim Laubfall zu verringern.
Wenn im Aquarium emerse Pflanzen auf die submerse
Kultur umgestellt werden, sind sie noch nicht verwurzelt und können sie sich noch nicht ausreichend über die Wurzeln versorgen.
Daher nutzen sie die Nährstoffreserven aus den alten Blättern, um neue Wurzeln zu bilden.
Es ist daher nicht ratsam beim Einpflanzen von Echinodorus
die alten Blätter zu entfernen "weil sie sowieso gelb werden". Die Pflanze entzieht dann den jüngeren Blättern Nährstoffe, um neue Wurzeln bilden zu können.
Die Pflanze benötigt die Verlagerung der Nährstoffe für einen guten Start in die Unterwasserwelt.
Darum werden immer einige der älteren Blätter gelb, egal wie viele vorher entfernt wurden.
Wegen dieser Fähigkeit der Pflanzen Stickstoff aus den alten Blättern zu entziehen, treten bei einer Unterversorgung mit Stickstoff zuerst Mangelsymptome an den älteren
Blättern auf. Ein geringer Mangel kann unbemerkt bleiben. Nur die Blätter haben eine kürzere Lebenserwartung.
Stärkerer Stickstoffmangel zeigt sich als Aufhellung bis hin zu einer zitronengelben Färbung, beginnend an den älteren Blättern.
Bei extremem Mangel wird die gesamte Pflanze gelb, sofern nicht andere Farbstoffe durch den Verlust von Chlorophyll sichtbar werden. Die
Verzweigung von Stängelpflanzen ist geringer. Stickstoffmangelpflanzen sind kleiner als gut versorgte Pflanzen.
Stängel und Blätter stehen steif aufrecht und auch die Blätter liegen dabei eng am Stängel an.
Diese Starrtracht kann bei Gräsern bis in die Blattspitzen reichen. (Bei Schwefelmangel hängen die Blattspitzen.)
Ursache ist ein erhöhter Anteil an Kohlehydraten.
Das kann bei manchen Pflanzenarten (z. B. Rüben und Erdbeeren) zu Rotfärbung durch Anthocyane
führen. Anders als bei Phosphatmangel treten sie aber nur zusammen mit hell grünen bis gelben Chlorosen auf.
Die Samen reifen bei Stickstoffmangel nicht aus.
Eine starke Stickstoffdüngung fördert das Wachstum, ohne das ausreichend hochmolekulare Kohlehydrate (Zellulose,
Lignin) gebildet werden. Die Zellwände werden dünner und der Gehalt an Zuckern im Zellsaft steigt. Dadurch wird die Pflanze nicht
nur anfälliger, sondern auch attraktiver für Pilze und saugende Insekten.
Zu starke Stickstoffdüngung fördert zum Beispiel den Befall mit Grauschimmel (Botrytis cinerea).
Eine zu hohe Konzentration von Ammonium in den Blättern führt zu Blattschäden. Eine Überversorgung mit Nitrat kann Blattrandnekrosen verursachen.
Bei Knollensellerie bilden sich bei zu großem Stickstoffangebot hohle Knollen.
Bei Salat verursachen eine Stickstoffüberdüngung oder eine unregelmäßige Stickstoffversorgung "Innenbrand". Dabei sterben Blätter im inneren des Kopfes ab und werden braun und trocken.
Nitratüberschuss soll nach einer von mehreren Theorien für die Cryptocorynen-Krankheit im Aquarium
verantwortlich sein, bei der durch Veränderungen des Lichtangebots oder Schwankungen der Wasserwerte die Blätter zerfallen.
Eingelagerte Stickstoffverbindungen werden möglicherweise schlagartig freigesetzt und führen zu einer Vergiftung der Pflanze.
Schwefelmangel kann je nach Pflanzenart und Situation Stickstoffmangel oder Stickstofftoxizität
verursachen. Ein Mangel an Molybdän stört den Stickstoff-Stoffwechsel, so dass auch durch Molybdän-Mangel Stickstoffmangelsymptome
ausgelöst werden können. Molybdänmangel kann aber auch Symptome von Nitrattoxizität verursachen.
An Leguminosen (Erbsen, Bohnen, Klee) wird Stickstoffmangel durch Kalzium-Mangel verursacht.
Da Kalzium für die Bildung der Knöllchen für die symbiotischen, stickstoffbindenden Bakterien nötig ist, können Leguminosen ihren Stickstoffgehalt bei Kalzium-Mangel nicht decken.
Der Stickstoff-Bedarf verschiedener Pflanzen ist unterschiedlich hoch. Bei gartenbaulichen und landwirtschaftlichen Kulturen
wird vor der Aussaat oder Pflanzung die Menge an mineralischem Stickstoff (Nmin) im Boden durch eine Bodenprobe bestimmt.
Es gibt aus der Praxis und auch aus der Forschung Erfahrungen, wie hoch das Stickstoffangebot sein soll, damit der Ertrag,
die Pflanzengesundheit und auch die Lagerfähigkeit nach der Ernte optimal sind.
Die Werte in der Tabelle sind in Kilogramm pro Hektar angegeben. Für den Hausgarten ist die Einheit Gramm pro Quadratmeter gebräuchlicher.
10 kg/ha entsprechen 1 g/m2.
Für Aquarien und Teichpflanzen gibt es nur wenige Erfahrungswerte.
Eichhornia-Arten benötigen viel Stickstoff.
Ein gutes Wachstum zeigen sie oft erst bei Nitratwerten über 10 mg/l. Günstiger sind für sie 30 bis 50 mg/l.
Bei Nessaea crassicaulis und Ammannia-Arten sollen bei Nitratwerten über 10 mg/l im Aquarienwasser Verkrüppelungen der Triebspitzen auftreten(Kramer 2001).
Verkrüppelungen an den Triebspitzen sind aber kein Symptome von Stickstofftoxizität. Solche Deformationen treten bei Kalzium-Mangel oder Bor-Mangel auf.
In einem gut bepflanzen, gut beleuchteten und üppig mit allen Nährstoffen versorgtem Aquarium nehmen die Pflanzen täglich 1 - 4 mg/l Nitrat und 0,2 - 0,6 mg/l Phosphat auf (5:1 bis 20:1).
Stickstoff ist für Pflanzen unverzichtbar. Wenn weder Nitrat, noch Nitrit und auch kein Ammonium im Wasser nachweisbar sind,
dann sind die Wasserwerte nicht "ok" und auch nicht "im grünen Bereich". Dann herrscht Stickstoffmangel.
Wundert euch also nicht, wenn trotz solch "toller" Wasserwerte, Kohlendioxid-Düngung und dem "Ich-bin-der Geilste-Aquarienpflanzendünger"
mit total vielen Vitaminen eure Pflanzen nicht wachsen.
Die Form in der Stickstoff ins Aquarium kommt als Eiweiß (Futter), Harnstoff (Ausscheidung der Fische), Ammonium, Nitrit oder Nitrat (Dünger) spielt keine Rolle.
Im Aquarium läuft wie im Boden oder in natürlichen Gewässern eine Abbaukette ab, bei der aus abgestorbenem tierischen
oder pflanzlichem Material und tierischen Ausscheidungen erst Ammonium (pH > 7 Ammoniak), dann Nitrit und zum Schluss Nitrat wird. Dabei
werden an Stickstoffreste aus Amminogruppen oder Harnstoff (CNH-Körper) Sauerstoff (O) angehängt. Dieser Vorgang erfolgt im Inneren von Bakterien,
die z.B. Ammonium als Nahrungsquelle nutzen und ihn in ihrem Stoffwechsel als Energiequelle verbrennen (oxidieren).
Auf die gleiche Weise produzieren wir Menschen bei der Energiegewinnung aus Kohlenhydraten (Zucker und Stärke) Kohlendioxid.
Nitrit (NO2) ist ein Abfallprodukt dieses bakteriellen Stoffwechsels. Andere Bakterien nutzen
das Nitrit um ihren eigenen Nahrungsbedarf zu decken und verbrennen das Molekül auch noch einmal.
Das daraus entstehende Nitrat (NO3)hat darum drei Sauerstoffatome.
Ist die Abbaukette im Aquarium vollständig, entsteht immer Nitrat und die anderen Stickstoffverbindungen werden verbraucht.
In der Einlaufphase eines Aquariums sind nur wenige Bakterien im Wasser bzw. im
Filter. Darum wird sich beim Abbau von Eiweißen und Harnstoffen erst Ammonium ansammeln.
Wenn Ammonium zur Verfügung steht, beginnen sich die Bakterien, die Ammonium nutzen zu vermehren.
Sie produzieren dann Nitrit. Erst wenn die Bakterien sich so stark vermehrt haben, dass jedes frei werdende Molekül von Ammonium
sofort verwertet werden kann, dann ist kein Ammonium im Wasser mehr nachweisbar. Gleichzeitig steigt der Gehalt an Nitrit so lange an
(Nitritpeak), bis sich die Nitrit-fressenden Bakterien ausreichend vermehrt haben. Sie bilden dann Nitrat aus dem Nitrit und Nitrat ist nicht giftig.
Da Ammoniak und Nitrit giftig für Fische sind, sollten Fische erst eingesetzt werden, wenn die Abbaukette vollständig ist,
d. h. erst dann, wenn Ammonium und Nitrit nicht mehr nachweisbar sind. Das ist dann der Fall, wenn der Nitritwert wieder absinkt.
Allerdings kann sich die Abbaukette nur dann entwickeln, wenn Stickstoff im Wasser ist.
Ist kein Stickstoff da, haben die Bakterien nichts zu fressen, vermehren sich nicht und die Abbaukette entwickelt sich nicht.
Es muss also schon vor dem Einsetzen der Tiere Fischfutter in Aquarium gegeben werden, damit die ersten
Bakterien der Abbaukette Nahrung haben und in der Folge auch die anderen Futter finden.
In der Einlaufphase ist es darum wichtig etwas Stickstoff zuzuführen und für eine ausreichende Belüftung zu sorgen.
Wenn Ihr keinen Stickstoff ins Aquarium gebt, dann kann es auch keinen Nitritpeak geben.
Der tritt dann erst auf, wenn Ihr die Tiere einsetzt und zu füttern beginnt. Da Nitrit giftig ist, können die Tiere dann daran sterben.
Oft wird Nitrat im Aquarium als Giftstoff verteufelt. Es ist jedoch in normalen Konzentrationen, in denen es im Aquarium auftreten kann, nicht giftig für Fische und Wirbellose.
Für einen kurze Überblick gebe ich hier einige Werte an, die von Camargo et. al (2005) zusammengestellt wurden.
Sie geben die Konzentrationen in mg Nitrat-Stickstoff pro Liter an und nicht in mg Nitrat pro Liter an.
Ich habe hier die Werte für euch umgerechnet:
Umrechnung Nitrat: 1 mg/l NO3-N = 4,43 mg/l NO3
Umrechnung Nitrit: 1 mg/l NO2-N = 3,28 mg/l NO2
Umrechnung Ammonium: 1 mg/l NH4-N = 1,28 mg NH4/l
Ausgewählt habe ich aus den Datensätzen die 96h LC 50.
Das ist die Konzentration, die in einem Versuch im Zeitraum von 96 Stunden (4 Tagen) bei 50 % der Testtiere zum Tod führte.
Köcherfliegenlarve (Hydropsyche occidentalis) frühes Larvenstadium: 431 mg Nitrat pro Liter
Köcherfliegenlarve (Hydropsyche occidentalis) letztes Larvenstadium: 483 mg Nitrat pro Liter
Köcherfliegenlarve (Cheumatopsyche pettiti) frühes Larvenstadium: 503 mg Nitrat pro Liter
Köcherfliegenlarve (Cheumatopsyche pettiti) letztes Larvenstadium: 733,165 mg Nitrat pro Liter
Neuseelanddeckelschnecke (Potamopyrgus antipodarum) erwachsen: 4616 mg Nitrat pro Liter (bis 863 mg/l keine Wirkung)
Blauer Sonnenbarsch (Lepomis macrochirus) fingerlang: 8750 mg Nitrat pro Liter
Katzenwels (Ictalurus punctatus) fingerlang (bei 22 - 30 °C): 6000 - 6200 mg Nitrat pro Liter
Regenbogenforelle (Oncorhynchus mykiss) fingerlang: 6000 mg Nitrat pro Liter
Wasserflöhe (Ceriodaphnia dubia) vertragen Nitratwerte von 250 mg/l ohne Probleme.
Bei einem Nitratwert von 1656 mg Nitrat pro Liter Wasser sterben 50 % der Tiere innerhalb von 48 Stunden.
Über die Auswirkung von Nitrat auf Menschen habe ich bereits ausführlich geschrieben (siehe Seite über Nitrat).
Nitrat ist viel weniger giftig als Nitrit und Ammonium. Ein Überschuß an Stickstoff im Aquarium fördert aber das Wachstum von Grünalgen.
Meade und Watts (1995) setzten Jungtiere von australischen Krebsen (Cherax quadricarinatus)
verschiedenen Konzentrationen von Nitrat, Nitrit und Ammonium aus.
Die Tiere vertrugen Konzentrationen von 4000 mg Nitrat pro Liter über einen Zeitraum von 120 Stunden (5 Tage) ohne Probleme.
Keines der Tiere starb. Auch eine Ammonium-Konzentration von etwa 30 mg/l führte in einem Zeitraum von 5 Tagen nicht zu Todesfällen.
Bei 60 mg/l starben 50 % der Tiere innerhalb von 24 Stunden. Nitritwerte von 32 mg/l wurden über einen Zeitraum von 5 Tagen ohne Todesfällen vertragen.
Bei einer Konzentration von 164 mg/l starben 50% der Tiere innerhalb von 24 Stunden. Ammonium ist für die diese Krebse vereinfacht ausgedrückt 2,5 mal so giftig wie Nitrit
und Nitrit 25 mal so giftig wie Nitrat.
Weitere Infos zu dem Thema findet Ihr auf der Seite für Einsteiger. Da geht es unter anderem auch um den Nitritpeak und Wasserwechsel.
Außerdem findet Ihr weiter unten auf dieser Seite einen Abschnitt über den Nährstoffbedarf der Pflanzen eines Aquariums.
| % Trockenmasse | |
| Salvinia molesta | 0,05 - 0,11 |
| Apfel Fruchtfleisch | 0,011 |
| Pontederia cordata Rhizome | 0,14 |
| Potamogeton mackianus Blätter | 0,14 |
| Apfel Blätter | 0,20 - 0,25 |
| Nymphoides indica Rhizome | 0,23 |
| Pontederia cordata Blätter | 0,24 |
| Nymphoides indica Blätter | 0,26 |
| Aponogeton elongatus Blätter bei pH 6,5 | 0,33 |
| Potamogeton pectinatus Blätter | 0,34 |
| Eichhornia crassipes Blätter | 0,38 |
| Nymphaea alba | 0,296 - 0,417 |
| Trapa natans | 0,33 - 0,58 |
| Vallisneria americana Wurzeln | 0,36 |
| Vallisneria americana Blätter | 0,41 |
| Vallisneria natans Blätter | 0,42 |
| Potamogeton pectinatus, Wurzeln | 0,47 |
| Nymphoides pelatata | 0,684 |
Phosphor kommt in der Pflanzen in Form von Phosphat vor. Der Anteil an der Trockensubstanz der Pflanze liegt zwischen 0,1 und 0,5%.
Der tatsächliche Gehalt ist abhängig vom Ernährungszustand der Pflanze, dem untersuchtem Pflanzenteil und dessen Alter.
Phosphat ist Bestandteil der Chromosomen, der Zellmembranen und dient als Energieträger (ATP).
Im Boden ist Phosphat nur wenig mobil. Es ist schwer löslich und wird in Humuskomplexen gebunden.
Eine Auswaschung ins Grundwasser erfolgt darum nicht.
Im Aquarium wird ein zu hoher Phosphatgehalt oft für das übermäßige Wachstum von Pinselalgen verantwortlich gemacht.
Es kann aber vorkommen, dass ein Aquarium mit 5 mg/l Phosphat völlig algenfrei ist, während ein anderes mit 0,1 mg/l Phosphat völlig überwuchert wird.
Aquarien, die auch eine gewisse Menge an Nitrat im Wasser (25 - 100 mg/l) haben, vertragen hohe Phosphatwerte nach meiner Erfahrung ohne Pinselalgenplage.
Fehlt Stickstoff steigt der Phosphatwert extrem an. Es können dann Werte bis 30 oder 40 mg Phosphat pro Liter Wasser auftreten.
"Normal" wären etwa 0,1 mg/l. Dieser Zustand geht oft mit verstärktem Wachstum von Pinselalgen einher. Abhilfe
schaffen regelmäßige Wasserwechsel (etwa alle 2 Tage) bis eine Verringerung des Phosphatgehaltes eintritt. Ein einmaliger Wasserwechsel reicht
nicht aus, weil aus dem Substrat ausgefallene Phosphorsalze nach dem Wasserwechsel gelöst werden.
Die Zugabe von Phosphatreduzierenden Zusätzen ist aus dem gleichen Grund keine Lösung. Das Phosphat wird
lediglich ausgefällt und löst sich wieder, wenn z.B. der pH-Wert oder die Gesamthärte verändert werden.
Wenn der Phosphatgehalt wieder auf ein vertretbares Maß (etwa 5 mg/l) gesunken ist, dann empfehle ich die Zugabe von stickstoffhaltigem Dünger (sofern kein oder nur wenig Nitrat vorhanden ist).
Denn die Pflanzen können das Phosphat nur aufnehmen, wenn sie wachsen. Alle Mangelfaktoren müssen dafür beseitigt werden.
Erfahrungsgemäß entziehen die Pflanzen bei gutem Wachstum Nitrat, Phosphat und Kalium in einem Verhältnis von etwa 15:1:15 aus dem Aquarienwasser.
Die Ergänzung des Pflanzenbestandes mit schnell wachsenden Pflanzen ist zu diesem Zeitpunkt sinnvoll, um den Entzug von Phosphat zu fördern.
In einem Versuch hat sich gezeigt, dass durch eine Erhöhung des Kohlendioxidangebotes bei Vallisneria spinulosa die
Phosphatkonzentration in den Blättern, Wurzeln und Stolonen um 35 bis 147 % ansteigt,
während der Stickstoffgehalt in der Pflanze sinkt (Yan X. et al 2006).

Phosphatmangel erzeugt kleine, grau-grüne oder rötliche Pflanzen. Ursache ist die Ansammlung von Anthocyanen
durch einen Mangel am energietransportierenden ATP. Die Rotfärbung beginnt in den älteren Pflanzenteilen und ist im Bereich der
Blattadern und Blattstiele besonders ausgeprägt. Die Pflanzen können sich dunkler färben oder blau-grün werden. Der Energiemangel hemmt
alle Stoffwechselvorgänge. Die Pflanzen kümmern und sterben von unten nach oben ab.
Auf sauren Böden zeigen die Pflanzen oft Phosphatmangelsymptome, weil das Phosphat dann in unlöslichen Salzen vorliegt. Durch Kalkung (Anhebung des pH-Wertes) lässt sich der Mangel beheben.
Mit zunehmendem Phosphatangebot steigt der Phosphatgehalt im Pflanzengewebe. Toxizitätssymptome sind aber bei Landpflanzen nicht bekannt.
Durch ein Überangebot an Phosphat im Boden kann aber die Aufnahme von Mikronährstoffen (Zink, Eisen) behindert werden.
Es kann auch Mangel an Kalzium, Bor, Kupfer und Mangan induziert werden.
Phosphatüberschuss ist im Aquarium recht häufig. Es kommt zu verstärktem Algenwuchs (Pinselalgen, Kieselalgen, Cyanobakterien).
Häufig tritt zusätzlich Eisenmangel auf, weil zu viel Phosphat die Aufnahme von Eisen behindert.
Regelmäßige Wasserwechsel sind nötig.
In überdüngten Gewässern ist vor allem der erhöhte Phosphatgehalt dafür verantwortlich, dass sich Plankton
vermehren kann. Durch die Trübung dringt weniger Licht ins Wasser und Unterwasserpflanzen werden verdrängt. Darum sind in
Gewässern mit hohem Gesamtphosphatgehalt (> 100 µg/l) nur sehr wenige submerse
Pflanzen zu finden. Beispielsweise waren in den 1960ern etwa 39% der flachen Gewässer (bis 2,5 m) in Nord-Ostdeutschland mit dichten
Pflanzenbeständen bewachsen, in den 1990ern waren es nur noch 2 % (Körner 2002).
Der Anteil von Schwefel an der Trockensubstanz der Pflanze liegt durchschnittlich zwischen 0,1-0,5 %. Schwefel ist Bestandteil von Chlorophyll und Chloroplasten, sowie von essentiellen Aminosäuren (Cystein und Cystin) und so am Aufbau wichtiger Proteine beteiligt. Aneurin (Thiamin oder Vitamin B1) enthält Schwefel. Ebenso Biotin (Vitamin H), das Co-Enzym A, das eine wichtige Rolle im Atmungsstoffwechsel spielt, und einige Enzyme, die bei der Stickstoffumwandlung in der Pflanze von Bedeutung sind. Auch in Zellmembranen ist Schwefel gebunden. Er ist damit für die Pflanze unverzichtbar. Die aromatischen Öle, die bei Senf und Lauch für den Geruch verantwortlich sind, sind ebenfalls schwefelhaltig. Daher haben solche Pflanzen auch mit z.T. mehr als 1 % in der Trockenmasse einen besonders hohen Schwefelgehalt. Entsprechend größer ist auch ihr Schwefelbedarf, gegenüber anderen Kulturpflanzen.
Im Zellsaft liegt Schwefel als CaSO4 und als SO24 - vor. überschüssiger Schwefel kann in den Blättern als
Sulfat gelagert werden. Diese Reserve kann mehr als die Hälfte des Gesamtschwefels einer Pflanze ausmachen. Erst wenn die völlig verbraucht ist,
treten an den jüngeren Blättern erste Mangelsymptome auf.
Die Mangelchlorosen treten zuerst an den jüngeren Blättern auf.
Es wird zwar Schwefel aus älteren Blättern verlagert, aber die Versorgung reicht nicht aus. Junge Blätter sind darum bei Schwefelmangel
kleiner und zeigen Chlorosen von hellgrün bis gelb, beginnend um die Blattadern herum.
Teilweise kann es durch Anthocyan-Einlagerung zu rot-violetten Verfärbungen entlang der Blattadern kommen.
Es werden Starrtrachtsymptome gebildet, d.h. die Stängel stehen starr aufrecht und die Blätter eng am Stängel
anliegend auch. Die Blätter sind kleiner und oft schmaler. Das Sprosswachstum
ist reduziert und die Stängel sind dünner. Das Wurzelwachstum ist weniger stark beeinträchtigt, so dass sich das Verhältnis
zwischen Sproß und Wurzel zu Gunsten der Wurzel verschiebt.
Abhängig davon in welchem Entwicklungsstadium akuter Mangel auftritt, können die Pflanzen auch stark kümmern.
Niedriger Sulfatgehalt im Boden kann eine verstärkte Chloridaufnahme provozieren, die wiederum zum Quellen des Gewebes
führt. Die Pflanzen zeigen dann kaum Chlorosen, haben aber gestauchte Internodien und ähneln Sukkulenten.
Die Menge an Chlorophyll sinkt, weil Schwefel Bestandteil von Chlorophyll und Chloroplasten ist. Durch Schwefelmangel kann es zu
Störungen in der Nitratreduktion im Pflanzeninneren kommen und dadurch Nitrattoxizität auftreten. Knöllchenbakterien, die zum
Beispiel in Symbiose mit Leguminosen leben, benötigen Schwefel für die Bindung von Luftstickstoff (N2).
Schwefelmangel hemmt sie und kann so zu Stickstoffmangel führen.
Bei Schwefelmangel vermindert sich die Eiweißqualität und der Stärkegehalt in den Pflanzen nimmt zu.
Schwefelmangel kann je nach Pflanzenart und Situation Stickstoffmangel oder Stickstofftoxizität verursachen.
In der Landwirtschaft und im Gartenbau trat Schwefelmangel früher nicht auf.
In den Industriestaaten kam viel Schwefeldioxid aus den Abgasen der Industrie mit dem Regen in den Boden.
In einigen Gebieten zerfraß dieser "saure Regen" aus verdünnter Schwefelsäure die Blätter der Bäume und führte zum Waldsterben.
Inzwischen gibt es diese kostenlose Schwefeldüngung vom Himmel nicht mehr. Schwefelsulfat wird aber mit der Düngung von Stickstoff (als Ammonium-Sulfat)
und bei der Kalium-Düngungen (als Kalium-Sulfat) mit ausgebracht.
Im Aquarium ist der Mangel unwahrscheinlich, weil Leitungswasser Sulfat enthält und Schwefel aus Futterresten frei wird. Schwefel
bzw. Sulfat ist das am häufigsten verwendete Gegenion für Salze in Aquarienpflanzendüngern.
Bei Kulturpflanzen kann sehr selten eine Toxizität durch ein Schwefelüberangebot auftreten. Bei Citrus beginnen die Blätter vom Rand her zu vergilben und bleiben kleiner. Die Früchte reifen aus, bevor sie ihre Zielgröße erreichen. Zuckerrüben, Tomaten, Baumwolle und Luzerne bleiben bei Schwefelüberschuß kleiner ohne Blattsymptome zu zeigen. Sorghumhirse und Bohnen kümmern sehr stark und zeigen deutliche Interkostalchlorosen und Nekrosen. Ihre Die Blätter fallen früh ab. Luzerne zeigt Chlorosen erst ab einem Blatt-S-Gehalt von etwa 2 %. Bei Citrus sind bereits ab 0,5 % Schäden sichtbar.


| % Trockenmasse | |
| Apfel Fruchtfleisch | 0,13 - 0,16 |
| Apfel Blätter | 1,3 - 1,6 |
| Nymphoides indica Rhizome | 1,75 |
| Aponogeton elongatus Blätter bei pH 6,5 | 2,38 |
| Nymphoides indica Blätter | 2,65 |
| Salvinia molesta | 1,55 - 3,54 |
| Pontederia cordata Rhizome | 3,20 |
| Pontederia cordata Blätter | 4,17 |
| Paprika Blätter | 5,5 |
| Paprika Früchte | 8,5 |
Der Anteil an der Trockensubstanz von Pflanzen ist zwischen 1 und 6 %.
Kalium ist wichtig für den Wasserhaushalt. Der Zellinnendruck wird durch hohe Kalium-Gehalte aufrecht erhalten.
Kaliumbetonte Düngung verbessert die Widerstandskraft von Pflanzen gegenüber Grauschimmel
(Botrytis cinerea) und anderen Pilzen, während eine stickstoffbetonte Düngung den Pilzbefall fördert.
Im Boden ist Kalium in Mineralien und Gesteinen gebunden.
Kalium ist in Glimmer, Feldspat und Tonmineralen (z.B. Illit, Monmorillonit und Vermiculit) enthalten und wird durch Verwitterung frei.
In tonreiche Böden und in Lößböden ist viel Kalium. In sandigem Boden kaum.
In organischer Substanz (Humus) ist Kalium im Boden kaum gebunden und wird schnell wieder frei gesetzt.
Auf sandigen Böden werden 20 - 30 kg Kalium pro Hektar ausgewaschen und sickern in Bodenschichten unterhalb des Wurzelraums.
In Böden mit besserer Kalium-Bindefähigkeit sind es nur 10 - 20 kg/ha.
Im Wasserwerk wird Kalium aus dem Wasser entfernt, darum ist es im Leitungswasser nur in geringer Menge vorhanden.
Um gute Erträge bei Gemüse und Getreide zu erzielen, reicht der Kalium-Gehalt im Boden und die Nachlieferung aus der Verwitterung nicht aus.
Darum muss im Garten und auf Äckern mit Kalium gedüngt werden.
Ein Teil des zugeführten Kaliums bindet sich auch wieder an Minerale und steht dann nicht als Pflanzennährstoff zur Verfügung.
In mineralischer Form wird Kalium als Kaliumchlorid, Kaliumsulfat, Kaliumoxid oder Kalimagnesia ausgebracht.
Im Bioanbau sind Gülle, Jauche und Stallmist die wichtigsten Lieferanten.
Kalium-Mangel führt zu einer Störung der Zellatmung, des Kohlehydrat- und Proteinstoffwechsels. Die Symptome zeigen sich
zuerst durch Blattrandchlorosen und Nekrosen an älteren Blättern. Bei Tomaten werden die Blattränder erst hell und trocknen dann ein.
Die Früchte färben sich nicht gut aus.
Gräser neigen bei Kaliummangel zur Lagerung. Das bedeutet, dass Getreidehalme umkippen.
Dadurch sind die Pflanzen anfälliger für Krankheiten und die Körner bilden sich nicht richtig aus.
Im Aquarium zeigen Kalium-Mangelpflanzen flächige Chlorosen, in deren Ausdehnung sich dann punktförmige Nekrosen bilden.
Bei Aponogeton zeigt sich Kaliummangel sehr deutlich. Diese braunen Flecken sind vor allem bei Aponogeton
rigidifolius und auch bei Aponogeton ulvaceus bekannt. Kluczniok (1989)
berichtet, dass beim ihm Echinodorus macrophyllus gelbe Flecken an den Rändern und an der Spitze der Blätter bekam, die dann
in Nekrosen übergingen und zu Löchern führten. Durch Zugabe von einem Teelöffel Kaliumsulfat auf 150 l Wasser konnte er die
Mangelsymptome beheben. Die Blätter wurden innerhalb von drei Wochen wieder grün.
Die selben Symptome zeigte auch Anubias barteri var. glabra. Als Nebeneffekt der Düngung verschwanden beim ihm die Blaualgen.
Der Kalium-Bedarf ist bei den verschiedenen Kulturpflanzen sehr unterschiedliche. Mange Pflanzen entziehen dem Boden nur
3 mg Kalium pro Quadratmeter, andere mehr als 100 g (siehe Tabelle Nährstoffentzüge).
Das hängt damit zusammen, dass Pflanzen wie Radieschen viel weniger Pflanzenmasse bilden, als zum Beispiel eine Gurkenpflanze.
Im Aquarium liegt der durchschnittliche wöchentliche Kaliumentzug durch die Pflanzen bei 10 - 30 mg/l.
Im Leitungswasser ist der Kalium-Gehalt in der Regel zu niedrig, so dass die Nachlieferung beim Wasserwechsel nicht ausreicht.
Kalium-Mangel gehört zu den am häufigsten auftretenden Mängeln im Aquarium.
| % Trockenmasse | |
| Apfel Fruchtfleisch | 0,005 |
| Paprika Frucht | 0,15 |
| Nymphoides indica Rhizome | 0,78 |
| Nymphoides indica Blätter | 0,87 |
| Pontederia cordata Rhizome | 1,08 |
| Salvinia molesta | 0,68 - 1,23 |
| Pontederia cordata Blätter | 1,37 |
| Paprika Blätter | 4,5 |



Der Kalzium-Gehalt in der Pflanze liegt bei etwa 0,5% der Trockensubstanz.
in Zitronenblättern sind Gehalte zwischen 1 und 7 % normal. Bei Orangen lassen sich Gehalte von 2,1 - 6,3 % feststellen.
Kalzium stabilisiert die Zellwände und die Membranen. Es wird nicht in Moleküle der Pflanze eingebunden, sondern liegt
nur als Ion im Zellsaft oder als Ion in den Zellwänden vor.
Der Kalzium-Bedarf ist bei Pflanzen unterschiedlich. Gräser neben weniger Kalzium auf als zweikeimblättrige Pflanzen.
Kräuter und Leguminosen (Bohnen, Erbsen, Klee) haben ein bis zu 5-mal höheren Kalzium-Bedarf als Gräser.
Tomaten nehmen 10- bis 15-mal mehr Ca2+ aus einer Nährlösung auf als Weizen.
Kalzium wird in der Pflanzen nur passiv mit dem Wasserstrom im Xylem transportiert.
Eine Verlagerung aus älteren Pflanzenteilen in jüngere ist nicht möglich.
Es wird vor allem in Pflanzenteile transportiert, die viel Wasser verdunsten und entsprechend viel Wasser nachziehen.
Blätter und Stängel von Pflanzen enthalten viel mehr Kalzium als die Früchte.
Während bei einem Apfelbaum etwa 40% der Assimilate (Zucker, Säuren etc.) in den Früchten zu finden sind,
gelangen nur etwa 2 % des aufgenommenen Kalziums bis dorthin.
Ist die Transpiration bzw. der Wasserzufluss zu gering, weil es sehr heiß, die Luftfeuchtigkeit zu hoch oder die Wasserversorgung
schlecht ist, kann das zu Kalzium-Mangelsymptomen führen.
Ein zu grosses Angebot von Kalium und Magnesium in der Nährlösung kann den Transport von Kalzium in der Pflanze behindern.
Ein ungünstiges Verhältnis von Ca2+ zu Mg2+ und K+ kann darum Kalzium-Mangelsymptome begünstigen.
Eine Düngung mit Nitrat erhöht den Gehalt an organischen Säuren (z. B. Zitronensäure, Apfelsäure) im Xylem.
Das verbessert den Transport von Kalzium in der Pflanze.
Ein erhöhter Gehalt an Oxalsäure führt zur Ausfällung von Kalzium-Oxalat und behindert den Kalzium-Transport.
Ca-Mangel führt zu einer erhöhten Durchlässigkeit der Zellmembranen.
Das stört den Zellstoffwechsel durch unkontrollierten Ein- und Austritt von Ionen und kann zur Auflösung der Zellen führen.
Die Mitochondrien, in denen die Zellatmung stattfindet (Kraftwerk der Zelle), sind besonders kalziumreich.
Bei Kalzium-Mangel nimmt ihre Zahl ab.
Auch die Chromosomen werden bei Kalzium-Mangel instabil und die Zell- und Zellkern-Teilung sind behindert.
Es entstehen sowohl besonders kleine als auch polyploide Kerne mit vielfachen Chromosomensätzen.
Kalzium wirkt zudem als Regulator auf die Hormone, die die Zellteilung steuern. Ein Mangel führt zu vergrößerten nicht ausdifferenzierten Zellen.
Darum sind Kalzium-Mangelsymptome besonders deutlich an meristematischem Gewebe von Wurzel und Spross zu sehen.
Die Triebspitzen und die jungen Blätter verkrüppeln. Die Wurzeln bleiben kurz, werden schleimig, verbräunen und sterben von der Spitze her ab.
Bei Tomaten werden die jüngeren Blätter vom Rand her gelb, beginnen am Rand einzutrocknen und rollen die Blattränder nach oben.
Die Blattadern können sich braun verfärben und in den Blattflächen bilden sich wässrige Flecken.
Bei Gurken wölben sich die Blätter nach oben und verkrümmen sich. Die Triebspitzen sterben ab.
Bei Sellerie trocknen die Ränder der Fiederblätter ein und sterben ab.
Bei Knollensellerie werden die Herzblätter und die Stiele der Pflanzen schwarz.
Eine zu intensive Düngung mit Stickstoff und Kalium kann bei Rotkohl und Chinakohl Kalziummangel induzieren, der zu Innenblattnekrosen führt.
Dann sind im Kopf Blattschichten braun und abgestorben.
Bei Fichten sterben die jungen Austriebe ab und verlieren die Nadeln. Dann schauen die kahlen Ästchen aus den Trieben heraus.
In den Blättern und Stängeln lösen sich bei Kalzium-Mangel die Zellen voneinander und verbraunen.
Der Zellsaft dringt die sonst luftgefüllten Zellzwischenräume. Es bilden sich braune Flecken in den Blättern und am Stiel.
Bei Aquarienpflanzen zeigen Hygrophila viel früher als andere Pflanzen Kalzium-Mangel und sind darum gute
Zeigerpflanzen. Bei Hygrophila-Arten ist Kalzium-Mangel sehr deutlich an Chlorosen entlang des Blattrandes zu erkennen.
Die Blätter an den Triebspitzen sind verdreht.
Am auffälligsten sind die Symptome an Früchten. Kalzium-Mangel verursacht Stippigkeit bei Äpfeln und Blütenendfäule bei Tomaten, Paprika, Melonen, Zucchini und Gurken.
Ein latenter Kalzium-Mangel lässt die Früchte verfrüht reifen, wenn sie noch nicht voll ausgewachsen sind.
Außerdem ist Lagerfähigkeit (z. B. bei Äpfeln und Birnen) bei geringerem Kalzium-Gehalt eingeschränkt.
Pflanzen sind ohne Kalzium nicht lebensfähig. Sämlinge sterben nach dem Keimblattstadium ab, wenn sie nicht genug Kalzium bekommen.
Ca2+ fördert die Auskeimung und die Knollenbildung von Kartoffeln, sowie die Fruchtentwicklung bei Erdnüssen.
Bei der Befruchtung ist Kalzium für die Keimung des Pollens auf der Narbe wichtig.
Bei Leguminosen ist Kalzium wichtig für die Knöllchenbildung durch die symbiotischen Bakterien. Dadurch wir die Stickstoffversorgung eingeschränkt.
Aus dem Grund verursacht Kalzium-Mangel Stickstoffmangelsymptome an Bohnen und Erbsen.
| % Trockenmasse | |
| Apfel Fruchtfleisch | 0,004 - 0,005 |
| Paprika Früchte | 0,2 |
| Nymphoides indica Rhizome | 0,21 |
| Apfel Blätter | 0,25 - 0,30 |
| Pontederia cordata Rhizome | 0,27 |
| Salvinia molesta | 0,29 - 0,37 |
| Pontederia cordata Blätter | 0,40 |
| Nymphoides indica Blätter | 0,44 |
| Paprika Blätter | 1,4 |

Anteil von Magnesium an der Trockensubstanz der Pflanze liegt zwischen 0,1 und 0,5 %. Magnesium ist das Zentralatom des Chlorophylls und in dieser Funktion nicht durch andere Nährstoffe ersetzbar. Außerdem ist es wichtig für die Proteinbiosynthese, weil es die Ribosomen aktiviert. Ohne Magnesium können keine Proteine (Eiweiße) hergestellt werden. Bei Magnesium-Mangel ist auch die Bildung von Pflanzenhormonen gestört. Der Stoffwechsel kommt dann zum erliegen. Etwa 300 verschiedene Enzymreaktionen werden in der Zelle durch Mg2+ beeinflusst. Unter anderem ist es an der Umwandlung von ADP zu ATP beteiligt. In Form von ATP wird Energie innerhalb der Zelle gespeichert und transportiert. Magnesium-Mangel stört darum den Energiestoffwechsel der Pflanzen. In geringem Maße ist Magnesium in dieser Funktion durch Mangan (Mn2+) ersetzbar.
Magnesium-Mangelsymptome zeigen sich immer zuerst an den älteren Blättern.
Bei einkeimblättrigen Pflanzen wie Roggen, Gerste und Mais
bilden sich bei Magnesium-Mangel chlorotische Flecken, die wie Perlen auf einer Schnur aufgereiht über das ganze Blatt verlaufen.
Die Chlorosen gehen in Nekrosen über und werden bräunlich, rötlich und weiß. Dadurch sind die Blätter bunt gestreift.
Bei Zweikeimblättrigen sind die Symptome verschieden.
Magnesium-Mangel an Kartoffeln, Blumenkohl und Gurken zeigt sich zunächst Chlorosen in den Interkostalfeldern.
Die Blattadern und der Blattrand bleiben manchmal noch grün, während die Chlorosen in der Blattfläche in Nekrosen übergehen.
Bei Futterrüben, Tomaten und Sonnenblumen beginnt die Chlorose am Rand der Blattspitze und geht auch am Rand
zuerst in Nekrosen über, während der Bereich um die Mittelrippe und die Blattbasis lange grün bleiben.
Bei Rotklee und Luzerne bleichen die Blätter vom Rand her aus und werden hellgrün, gelblich und zum Schluss fast weiß, bevor das Gewebe abstirbt.
Auch hier bleiben die Mittelrippe und die Seitenadern lange grün.
Magnesium-Mangel tritt beim Fehlen von Magnesium in im Wurzelraum der Pflanzen auf, aber auch bei einem Überangebot von Kalium.
Bei einer Düngung mit Ammoniumsulfat kann das Ammonium (NH+4 Magnesium von den Aufnahmeplätzen an der Wurzel verdrängen und so Magnesium-Mangel induzieren.
Eine Nitratdüngung fördert dagegen die Aufnahme von Magnesium.
Durch Kalkung wird die Freisetzung von Aluminium (Al3+) und Mangan (Mn2+) aus dem Boden gehemmt, was sich positiv auf die Magnesium-Aufnahme auswirkt.
Wird gleichzeitig aber zu viel Kalzium (Ca2+) zugeführt, kann Kalzium die Magnesium-Aufnahme hemmen.
Der Bedarf an Magnesium ist bei Pflanzen sehr unterschiedlich. Einen hohen Bedarf haben Zitrus-Bäume, Tabak, Kartoffeln, Rüben, Kohl, Baumwolle, Klee und Mais.
Sie zeigen Magnesium-Mangelsymptome bei einem Magnesium-Angebot, bei dem andere Arten problemlos wachsen.


Eisen gehört zu den Mikronährstoffen. Sein Anteil an der Trockensubstanz der Pflanze ist etwa 0,01%.
Die Gehalte können aber stark schwanken.
Da Eisen in der Pflanze nicht verlagert und neu verteilt werden kann, muss die Pflanzen ständig mit ausreichend Eisen versorgt werden, um Mangelsymptome zu vermeiden.
Eisen ist Bestandteil von Chlorophyllvorstufen und ist wichtig für die Umwandlung von Stickstoff in der Pflanze.
Im Boden liegt Eisen meistens in gebundener Form vor. Es ist generell schlecht verfügbar und wird nicht mit dem Regen in tiefer Bodenschichten ausgewaschen.
Pflanzen verfügen über verschiedene Mechanismen, um Eisen aus seinen Verbindungen zu lösen.
Auf basischen Böden wachsen Gräser, die durch die Ausscheidung von Phytosiderophoren (Chelatbildner) Eisen komplexieren können.
Dieser Vorgang ist unabhängig von pH-Wert und Temperatur.
Nicht-Gräser reagieren auf einen Mangel an Eisen mit verringertem Wurzellängenwachstum, verdickten Wurzelspitzen (Vergrösserung
der Membranoberfläche) und einer Zunahme der Wurzelhaarzahl. Es werden verstärkt H+-Ionen ausgeschieden und damit aktiv der pH-Wert gesenkt.
In stark alkalischem Milieu werden die Protonen abgepuffert und diese Strategie der Eisenaufnahme bleibt erfolglos.
Eisen kommt im natürlichen Boden in unterschiedlichen Konzentrationen vor. Hochmoore sind meist frei von Eisen. Laterite und
Terra rossa-Böden der Tropen können bis 10% oder mehr Eisen enthalten. Es ist Bestandteil verschiedener Minerale (Hornblenden, Augite, Biotite
u.a.) und wird durch Verwitterung frei als dreiwertige Oxide und Hydroxide, die wasserunlöslich sind. Ein geringer Teil wird an Tonminerale
gebunden oder bildet mit Phosphaten und Carbonaten Salze.
Niedrige pH-Werte, ein geringer Sauerstoffgehalt und viele organische Chelatbildner erhöhen die Verfügbarkeit von zweiwertigem Eisen.
Bereits im neutralen pH-Bereich ist der Eisengehalt in der Bodenlösung häufig sehr gering.
Eisenmangel tritt bei hohen pH-Werten (hoher Karbonat-Härte) und guter Belüftung auf, da dann das Eisen in
Form von Carbonaten ausfällt.
Bei der Aufnahme der Ionen durch die Pflanze besteht eine Konkurrenz zwischen Fe2+ einerseits und Ca2+
und Mg2+ (Gesamthärte) andererseits. Auch ein verstärktes Angebot an Phosphaten und Nitrat verschlechtert die Eisenaufnahme durch die Pflanze.
Die Phosphate fallen als Eisen-II-Phosphate aus der wässrigen Bodenlösung aus und können nicht aufgenommen werden.
Nitrat (NO32-) wird von der Pflanze im Austausch gegen OH- oder HCO3- - Ionen aufgenommen, was den pH-Wert anhebt
und die Verfügbarkeit von Eisen so herabsetzt.
Kupfer-Toxizität führt durch die Konkurrenz zwischen Eisen- und Kupfer-Ionen zu starkem Eisenmangel.
Der Transport im Boden erfolgt als Eisen-III-Chelate mit dem Wasserstrom. Die Pflanze nimmt Eisen in Form von Eisen-III-Chelaten oder Fe2+-Ionen auf.
In der Pflanze wird das zweiwertige Eisen oxidiert (zu Fe3+) und mit Citrat oder Malat im Komplex transportiert. Für die
Nutzung im Stoffwechsel muss das Eisen in den Blättern wieder reduziert werden. Dieser Vorgang ist abhängig vom Licht und findet bei einer
Einstrahlung von 420 nm statt (Fotosynthese: 400-500 nm und 625-700 nm).


Eisen wird in der Pflanze nicht mehr verlagert, wenn es einmal im Blatt angekommen ist.
Daher treten die Mangelsymptome zuerst an den jüngste Blättern auf.
Die Blätter hellen sich zuerst auf. Hält der Mangel länger an, bilden sich gelbe oder weiße Blätter, die brüchig und glasig sein können.
Mit jedem neuen Blatt, das sich bildet, werden die Symptome deutlicher. Die Blattadern bleiben noch lange grün, während die Blattspreite immer heller wird.
Im Extremfall sterben die Pflanzen von oben her ab. Die Wurzeln von Eisenmangelpflanzen sind kurz und braun verfärbt.
Ob die Blätter sich gelb oder weiß färben, hängt von der Pflanzenart ab und davon, welche Farbstoffe außer dem grünen Chlorophyll noch in den Blättern vorhanden sind.
Ein hohes Angebot an Phosphat (Bildung unlöslicher Eisenphosphate) und ein zu hoher pH-Wert verstärken den Mangel.
Auch hohe Nitratgehalte, hohe Karbonat- und Gesamthärte, sowie Kaliummangel wirken sich negativ auf die Eisenaufnahme aus.
Bei zu geringen Temperaturen ist die Eisenaufnahme ebenfalls beeinträchtigt.
Bei tropischen und subtropischen Pflanzen darf darum die Temperatur im Wurzelraum während der Wachstumsphasen nicht dauerhaft unter 20 °C sinken.
Durch Eisenmangel chlorotische Blätter werden durch eine Eisendüngung nicht grün. Erst die neu gebildeten Blätter sind wieder normal gefärbt.
Im Aquarium ist Eisenmangel die am häufigsten auftretende Mangelerscheinung.
Die Empfindlichkeit gegenüber Eisenmangel ist unterschiedlich stark, so dass es möglich ist, dass einige Pflanzen
Eisenmangel zeigen und andere wunderbar wachsen. Das ist besonders gut im direkten Vergleich von Cabomba paliformis und Cabomba caroliniana zu sehen.
Die Ursachen von Eisenmangel im Aquarium:
1. absoluter Mangel an Eisen (im Leitungswasser nicht enthalten)
2. Mangel an verfügbarem Eisen
a) zu hoher Nitratgehalt (Wasserwechsel machen)
b) zu hoher Phosphatgehalt (Wasserwechsel machen)
c) zu hohe Karbonathärte (angepasste Arten verwenden, Wasser enthärten)
d) zu hohe Gesamthärte (angepasste Arten verwenden, Wasser enthärten)
e) zu hoher pH-Wert (angepasste Arten verwenden, pH-Wert senken)
Eisen kann auch zu Vergiftungen führen, besonders bei Kalzium-, Phosphat- und Sauerstoffmangel. Eine
Überdüngung mit Eisen behindert die Aufnahme von Mangan.
Eisenüberschuss äußert sich durch Braun- und Gelbverfärbung der ältesten Blätter,
beginnend an den Spitzen der Blätter.
Pflanzen, die an aquatische Standorte angepasst sind haben Systeme entwickelt, die eine Oxidation von Eisen ermöglichen
um dadurch Eisentoxizität zu vermeiden (z.B. Reis). Einige Pflanzenarten benötigen Silizium um ihre Eisenaufnahme zu regulieren.


Der durchschnittliche Anteil von Mangan an der Trockensubstanz der Pflanze beträgt 0,002 - 0,005%.
Mangan reguliert Enzyme im Eiweiß- und Kohlehydratstoffwechsel der Pflanze. Es aktiviert Enzyme im Krebszyklus, der für die Grundatmung von Pflanzen wichtig ist.
Die Aufnahme über die Wurzel ist unproblematisch, wenn ausreichend Mangan vorhanden ist.
In Böden mit hohem pH-Wert ist Mangan aber schlecht verfügbar. Dann kann es der Pflanze über Blattdüngung zugeführt werden.
Auf manganarmen Standorten kann durch eine Blattdüngung der Ertrag von Getreide um bis zu 66 % gesteigert werden.
Wie effektiv die Blattdüngung sich auswirkt ist abhängig von der Getreideart und von der Sorte.
Pflanzen nehmen Mangan in unterschiedlichem Maße auf.
In der gleichen Nährlösung aufgezogene Pflanzen haben unterschiedliche Mangan-Gehalte in den Blättern.
Hafer, Buchweizen und Spinat nehmen unter gleichen Bedingungen etwa 3 - 4 mal so viel Mangan auf, wie Tomaten.
Erbsen, Salat und Sonnenblumen lagern 5 bis 6 -Mal soviel Mangan in ihren Blättern ein wie Tomaten.
Als Mikronährstoff ist Mangan unverzichtbar. Ein zu hohes Angebot verursacht aber Toxizitätssymptome.
Manganmangel zeigt sich als erstes an Chlorosen in der Wachstumszone. Sowohl die grünen als auch die gelben Blattpigmente sind reduziert.
Betroffen sind zunächst die Interkostalfelder,
dann bilden sich gelbe Flecken, die in Nekrosen übergehen. Oft bilden sich Deformationen an den jüngste Blättern.
Durch den Mangel an Chlorophyll und Karotinoiden ist die Photosynthese eingeschränkt. Mangan ist aber auch direkt an den Vorgängen bei der Photosynthese beteiligt.
Bei Manganmangelpflanzen ist darum der Einbau von Kohlenstoff und auch die Freisetzung von Sauerstoff eingeschränkt.
Dieser Effekt ist bereits messbar, wenn noch keine sichtbaren Symptome vorhanden sind.
Auf schweren Böden mit einem neutralen pH-Wert ist Mangan in der Regel in ausreichender Menge vorhanden.
Auf alkalischen Böden können Mangelerscheinungen an Gemüsepflanzen und Getreide auftreten.
Ursache für Manganmangel an Aquarienpflanzen ist eine häufig einseitige Eisendüngung.
Die Pflanzen reagieren unterschiedlich empfindlich auf Manganmangel. Weil Mangan viele Stoffwechselvorgänge beeinflusst, sehen die Mangelsymptome an den Pflanzen sehr verschieden aus.
Bei Hafer und Weizen bilden sich in der Mitte aller Blätter blaugrüne, vertrocknete Flecken (Dörrfleckenkrankheit).
Die Blätter vertrocknen von der Spitze her. Bei Sommergerste und Mais bilden sich fleckige Nekrosen zwischen den Leitgefäßen und laufen später zu Linien zusammen.
Bei Zuckerrüben, Wirsing, Tabak, Tomaten und Sonnenblumen bilden sich kleine gelbe, chlorotische Flecken in den Interkostalen, die bei zunehmendem Mangel immer größer werden und in Nekrosen übergehen.
An Kartoffeln bilden sich schwarze Punkte auf den Blättern, die später zu braunen Nekrosen zusammenlaufen.
Diese schwarzen Punkte sind auch bei Buschbohnen zu beobachten.
Rote Bete bekommt bei Manganmangel kleine, scheckige Blätter mit rötlichen Chlorosen, die zu Nekrosen werden.
Bei Möhren bleiben die Blätter kleiner und werden chlorotisch. Die Möhrenrüben sind beinig und bärtig von zahlreichen Seitenwurzeln.
Gurkenpflanzen und Spinat bekommen chlorotische Blätter, die hellgelb bis weiß werden, während
die Blattadern lange grün bleiben. Im Gegensatz zu einer Eisenmangelchlorose sind hier vorn aber vor allem die mittleren Blätter betroffen.
Kopfsalat wird bei Manganmangel im ganzen heller grün bis gelblich.
Im Aquarium tritt Manganmangel selten auf, da Mangan als Spurenelement in Aquarienpflanzendüngern enthalten ist.
Eine einseitige Eisenüberdüngung kann aber Manganmangel induzieren.
Bei Echinodorus palaefolius treten viele kleine Punkte auf und
die Blätter zeigen Wellen in der Spreite. Echinodorus maculatus zeigt ausgeprägte Nekrosen. Weniger Punkte sind an
Echinodorus parviflorus ´Tropica´und E. cordifolius zu sehen.
Sehr vereinzelt nur an Echinodorus grisebachii "Bleheri", Echinodorus x ´Rubra´ und E. x barthii.
An den klein bleibenden Zwergschwertpflanzen Helanthium angustifolium, Helanthium bolivianum und Helanthium latifolium treten Chlorosen auf.
Echinodorus x ´Harbig rot´, Echinodorus x ´Ozelot´, Echinodorus amazonicus und Echinodorus osiris bleiben unter den gleichen Bedingungen symptomlos.
Kleemann (1990) beschreibt die "Christbaumkrankheit" bei der es sich nach seiner Meinung um Manganmangel handelt. Dabei ist die Blattspreite bei Cryptocorynen zwischen den Adern aufgehellt, die Adern bleiben aber
dunkel. Er bezeichnet diese Symptome als "Christbaumkrankheit", weil ihn die Adern an trockene Tannenzweige erinnerten.
Mangantoxizität kann bei pH-Werten unter 5,5 und bei Sauerstoffmangel im Boden vorkommen. Blattrandchlorosen entwickeln sich weiter zu Nekrosen. Die Blätter sind gekrümmt. Es sind deutlich braune Punkte aus oxidierten Phenolen (in den Zellwänden) zu sehen. Die Kalzium-Aufnahme wird gestört, so dass es zu einem Ca-Mangel kommt. Silizium wirkt der Mangan-Toxizität entgegen.
| mg /kg Trockenmasse | |
| Gerste | 2,3 |
| Roggen | 3,1 |
| Porree | 3,1 |
| Weizen | 3,3 |
| Zwiebel | 4,3 |
| Mais | 5,0 |
| Flachs | 7,1 |
| Spinat | 10,9 |
| Sellerie | 11,9 |
| Endivien | 13,1 |
| Kartoffel | 13,9 |
| Tomate | 15 |
| Ackerbohne | 15,4 |
| Aponogeton elongatus Blätter bei pH 6,5 | 15,5 |
| Erbse | 21,7 |
| Weißer Senf | 22,2 |
| Wegerich | 22,5 |
| Möhre | 25,0 |
| Tabak | 25,0 |
| Weißkohl | 37,1 |
| Sojabohne | 37,2 |
| Linse | 41,4 |
| Steckrübe | 49,2 |
| Radieschen | 64,5 |
| Rübe | 75,6 |
| Löwenzahn | 80,0 |
| Mohn | 94,7 |
Der Anteil von Bor an der Trockensubstanz der Pflanze liegt zwischen 0,0002 % - 0,009 %.
Es wird passiv als Borsäure B(OH)3 oder aktiv als Borat-Ion (B(OH)4-) aufgenommen.
In der Pflanzen wird es wie Kalzium im Xylem mit dem Wasserstrom transportiert.
Der Borbedarf verschiedener Pflanzen ist unterschiedlich. Kreuzblütler (Kohl, Senf, Raps,Rüben etc.) benötigen relativ viel Bor.
In der Pflanze ist Bor wichtig für die Stabilität der Zellmembranen. Außerdem erhöht es die Aktivität von Enzymen und erleichtert und beschleunigt damit viele Stoffwechselvorgänge.
Es ist wichtig für die Bildung von Kohlenhydraten, Eiweißen, Kernsäuren, den Stickstoffstoffwechsel, die Pollenkeimung, die Fruchtbildung und den Hormonhaushalt der Pflanze.
Bereits ein latenter (äußerlich nicht sichtbarer) Mangel verursacht eine Ansammlung von Stärke in den Chloroplasten, da bei Bormangel der Umbau der Stärke in Zucker nicht mehr möglich ist.
Gleichzeitig werden weniger Stärke und Zucker in die Speicherorgane (Knollen und Rüben) transportiert.
Mit steigendem Bor-Angebot steigt die Aufnahme von Kalium und Kalzium.
Das verbessert z. B. bei Tomaten das Wachstum der Pflanze, den Fruchtansatz, den Ertrag und die Haltbarkeit der Früchte.
Bei Rüben, Kohl, Baumwolle, Raps, Sonnenblumen, Mais und Soja verbessert Bor den Fruchtansatz und senkt den Anteil an tauben Samen.
Bei Kartoffeln wird durch Bordüngung die Schale fester. Dadurch steigt deren Widerstandskraft gegen Kartoffelschorf.
Wichtig für die Wirkung von Bor scheint in vielen Fällen nicht der absolute Gehalt in der Pflanze zu sein, sondern das Verhältnis von Kalzium zu Bor (Ca/B-Verhältnis).
Bei einem Ca/B- Verhältnis von 15 - 100 wachsen Sellerieknollen normal. Bei einem Ca/B-Verhältnis von >100 treten Bormangelsymptome auf.
Bei Kohlrüben tritt Bormangel bei Borgehalten unter 18 mg B pro kg Trockenmasse auf und bei einem Ca/B-Verhältnis >170.

Bormangel betrifft vor allem meristematisches (teilungsfähiges) Gewebe. Das Wurzelwachstum wird eingeschränkt.
Junge Blätter haben gelbe bis rötliche Verfärbungen, die in Nekrosen übergehen können.
Die Blätter sind kleiner, haben verformte Blattflächen und eine unsymmetrische Nervatur.
An den Stängeln, Blattstielen und Blattadern bilden sich Risse und Verkorkungen.
Die Triebe sind stark gestaucht, bis hin zur Rosettenbildung bei Stängelpflanzen.
Stirbt die Triebspitze ab, treiben die Seitenknospen stark aus und sterben oft wenig später ebenfalls ab, so dass ein unregelmäßiger, besenartiger Wuchs entsteht.
Die Bildung von Blüten und Samen ist verringert. Die Pollenkeimung ist behindert, weil das Pollenschlauchwachstum viel Bor erfordert.
Die Wurzeln sind an der Spitze verdickt, braun und glasig. Oft platzen sie auf. Es bilden sich Hohlräume in Früchten und Rüben.
Bei Ackerbohnen werden die Triebspitzen gelb oder braun. Erbsen sind widerstandsfähiger gegen Falschen Mehltau (Peronospora pisi), wenn sie gut mit Bor und Mangan versorgt sind.
Bormangel an Knollensellerie äußert sich durch verbräunen der Knollen und Hohlraumbildung. Zusätzlich zeigen die Blattstiele Querrisse.
Bei Rote Bete werden die Herzblätter trocken, das Gewebe der Rüben wird schwarz. In Kohlrüben bilden sich glasige, wässrigen Zonen und schwarze Hohlräume.
Bei Kopfkohl werden die Strünke braun und hohl.
Bei Mais wirkt sich Bormangel auf die Bildung der Kolben aus. Die Befruchtung ist gestört und es werden nur wenig Körner angesetzt.
Geringe Borgehalte findet man vor allem auf leichten bis mittleren Sandböden in Gebieten mit hohen Niederschlagsmengen.
Dort ist der Borgehalt im Boden durch Auswaschung insgesamt niedrig.
Auf Tonböden mit einem alkalischen pH-Wert tritt Bormangel selten auf, weil der Mikronährstoff hier in wasserunlöslicher Form vorliegt und nicht ausgewaschen wird.
Durch eine Kalkung kann der pH-Wert im Boden zu stark erhöht werden, so dass die Pflanzen kein Bor mehr aufnehmen können.
Im Aquarium tritt Bormangel selten auf. Bor ist in Mikronährstoffdüngern enthalten.
Bei einer Überdüngung mit Bor in Versuchen mit Nährlösungen wurde festgestellt, dass Bortoxizität die Keimung und das Sprosswachstum hemmt. Sie verursacht außerdem Chlorosen und Nekrosen an den Blättern und Stängeln.
Allgemeine Informationen
Anteil an der Trockensubstanz der Pflanze: 0,0006 %.
Kupfer ist für pflanzliches Wachstum unverzichtbar.
Ein latenter Mangel ohne sichtbare Symptome kann schon Ertragseinbußen bis 20 % zur Folge haben.
Während ihrer Entwicklung verändert sich die Kupferaufnahme der Pflanze. Besonders große Mengen nehmen Jungpflanzen auf.
Bei Getreide ist die Kupferaufnahme beim Schossen am größten.
Algerienhafer (Avena byzntina) wächst mit Kupfergehalten von 0,7 mg/kg in der Trockenmasse der Blätter ohne Mangelsymptome.
Hafer benötigt dagegen Blattkupfergehalte von 5 - 8 mg/kg.
Als besonders Kupferbedürftig gelten Sonnenblumen. Bei Ihnen treten schon Wuchshemmungen durch Kupfermangel bei Blattgehalten von 4 - 6 mg/kg Trockenmasse auf.
Gleichzeitig wirkt Kupfer in höheren Konzentrationen giftig. Bei manchen Pflanzen treten schon bei 17 mg/kg Kupfer in den Blättern Toxizitätssymptome auf.
Andere Arten vertragen Blattgehalte von 25 - 30 mg/kg.
Bei untergetauchten Wasserpflanzen ist die Kupferaufnahme konstant.
Kupfer wird unabhängig von der Konzentration in der Außenlösung immer in konstanter Rate von 0,11 mg/l und Tag von
Myriophyllum aquaticum, Ludwigia palustris und Mentha aquatica aufgenommen (Kamal et al. 2004).
Der Transport in der Pflanzen erfolgt im Xylem und im Phloem ist aber langsam. In den Wurzeln ist der Kupfergehalt höher als in den Blättern.
Kupfermangel führt zu starken Chlorosen bis hin zur Weißfärbung. Die Blätter verkrüppeln und drehen sich ein. Hohe Stickstoffmengen und hohe pH-Werte verstärken den Mangel. Jüngste Blätter sterben ab bevor sie Farbe ausbilden.

Im Garten ist nicht mit Kupfer-Toxizität zu rechnen.
Im Aquarium kann es zu Kupfervergiftung kommen.
Wenn neue Wasserleitungen aus Kupfer sind, dann kann das Leitungswasser 0,1 mg/l Kupfer oder mehr enthalten.
Arten, die sehr empfindlich auf Kupfer reagieren (Vallisnerien, Wasserpest und andere) zeigen aber schon bei Konzentrationen von 0,02 mg/l Deformationen.
Besonders in Bereichen mit hartem Wasser bildet sich aber schnell eine wasserunlösliche Schicht in den Rohren, die das Auswaschen von Kupfer deutlich reduziert.
Die Verwendung von Wasseraufbereitungsanlagen zur Wasserenthärtung fördert dagegen die Kupferfreisetzung aus den Rohren. Die
Verwendung eines Wasseraufbereiters - auch zum Schutz von Wirbellosen - ist darum bei der Verwendung von Leitungswasser in einigen Regionen unverzichtbar.
Hauptsächlich stellt aber das Kupfer aus Fischmedikamenten und Mitteln zur Algenbekämpfung ein Problem dar.
Es wird schlagartig in hohen Konzentrationen zugegeben und kann schnell ganze Pflanzenbestände vernichten.
Das Bild rechts zeigt einen Kupferschaden an Egeria densa. Die Fadenalgen sind von der gewählten Kupfersulfatmenge unbeeinflusst geblieben.
Der Anteil an der Trockensubstanz der Pflanze beträgt etwa 0,002 - 0,01 %.
Die Zinkaufnahme von Landpflanzen ist sehr unterschiedlich. Mais nimmt mehr Zink aus Nährlösungen auf als Tomaten.
Beeinflusst wird die Aufnahme vor allem durch den pH-Wert und das Phosphatangebot. Niedrige pH-Werte und ein geringes Phosphatangebot erleichtern die Zinkaufnahme.
Ein erhöhtes Phosphatangebot, behindert den Weitertransport des Zinks aus den Wurzeln in die Blätter.
Eine optimale Versorgung liegt bei einem P/Zn-Verhältnis von etwa 54 - 151 in den Blättern vor. Ein P/Zn-Verhältnis von über 211 weist auf Zinkmangel hin.
Von untergetauchten Wasserpflanzen (Myriophyllum aquaticum, Ludwigia palustris und Mentha aquatica)
wird es unabhängig von der Konzentration in der Außenlösung immer in konstanter Rate von 0,48 mg/l und Tag aufgenommen (Kamal et al. 2004).
Zinkmangel tritt häufig zusammen mit Eisenmangel und unter den gleichen Bedingungen auf. Besonders ein hohes
Phosphatangebot kann der Auslöser sein. Die Interkostalfelder der jüngeren Blätter werden chlorotisch.
Toxizität ist selten und äußert sich wie Eisentoxizität.
Der Anteil an der Trockensubstanz in der Pflanze beträgt bei Molybdän nur 0,00001 %.
Bei Mangel verfärben sich ältere Blätter blaugrün (Ursache ist eine Störung im Stickstoff-Stoffwechsel).
Später kommt es zu Chlorosen.
Bei Blumenkohl verursacht Bormangel Klemmherzigkeit und verkrüppelte Blätter. Die Pflanzen bilden keine Blume.
Bei zu niedrigen pH-Werten ist Molybdän nicht verfügbar.
| % Trockenmasse | |
| Nymphoides indica Blätter | 0,33 |
| Nymphoides indica Rhizom | 0,20 |
| Pontederia cordata Blätter | 0,07 |
| Pontederia cordata Rhizome | 0,27 |
| Salvinia molesta | 0,26 |
Chlorid (Cl-) beeinflusst den Wasserhaushalt und die Proteinstabilität.
Es ist für einige Pflanzen unverzichtbar. Andere Pflanzen regieren sehr empfindlich auch Chlorid.
Chlor (Cl2) ist in Meerwasser enthalten und in Küstennähe in größerer Menge im Boden und auch in der Luft.
Mit dem Wind wird es auch ins Landesinnere getragen und wird vom Regen ausgewaschen.
Nach Messungen der Landesanstalt für Umwelt, Messungen und Naturschutz Baden-Württemberg gelangen auf der Schwäbischen Alp
mit dem Regen zwischen 1,4 und 5,5 kg Chlorid pro Hektar und Jahr in den Boden (Link zur Quelle).
Das Chlor-Ion wird von den Pflanzen aus dem Boden und Chlorid (Cl2)auch aus der Luft aufgenommen.
Bei Chlorid-Mangel beginnen die Pflanzen an der Triebspitze zu welken. Sie produzieren weniger Sauerstoff und weniger von dem energietransportierendem ATP.
Die Zellteilungsrate ist verringert. Dadurch verlangsamt sich das Wachstum der Blätter und sie bleiben kleiner.
Die Samen von Chlorid-Mangelpflanzen haben eine schlechte Keimfähigkeit. Bei starkem Mangel werden keine Früchte und Samen mehr gebildet.
Die Blattränder wellen sich und die Blätter wölben sich auf. Es bilden sich Chlorosen in den Interkostalen. Später zeigen sich purpurbronzefarbenen Verfärbungen und Nekrosen.
Bei Gräsern bilden sich weiße Flecken in den heranwachsenden Blättern. Sie bilden sich nicht vollständig aus und sind zusammengerollt.
Chloridmangel tritt im Garten und im Aquarium nur selten auf. Es gibt einen Eintrag aus der Luft, aus Leitungswasser und aus Dünger.
Kokospalmen benötigen relativ viel Chlorid. Im Landesinneren (20 - 25 km vom Meer entfernt) tragen sie deutlich weniger Früchte als in Küstennähe.
Häufiger als Chlorid-Mangel treten Toxizitätssymptome auf. Besonders in Bereichen in denen gegen Glatteis Salz eingesetzt wird, enthalten die Böden zu viel Chlorid.
Der Überschuß führt dazu, dass sich von den Blatträndern der Pflanzen Nekrosen ausbilden und sie sich aufrollen. Die Blätter sterben ab.
Die Pflanzen bilden wiederholt neue Blätter, die aber auch absterben und abgeworfen werden. Dann sterben erste Zweige von der Spitze her ab.
Bei Bäumen können ganze Kronenpartien betroffen sein. Zum Schluss gehen die Pflanzen ein.
Besonders empfindlich gegen Salzschäden sind Zwiebeln, Pfirsiche, Zitronen, Bohnen, Erbsen, Pflaumen, Apfelbäume, Linden, Ahorn, Rotbuche, Ulmen und Gemeiner Weißdorn.
Wenig anfällig sind Erdbeeren, Puffbohnen, Aprikosen, Reis, Sorghum-Hirse, Hängebirken, Stieleichen und Roteichen.
Als sehr salztolerant gelten Gerste, Tabak, Weizen, Tomaten, Baumwolle, Mangold, Rote Bete, Spinat, und Zuckerrüben.
Unter den Wasserpflanzen gibt es sehr chlorid-verträgliche Arten, die im Brackwasser und in küstennahen Gebieten wachsen.
Andere sind dagegen sehr empfindlich. Zu den chloridempfindlichen Aquarienpflanzen gehören z. B. Nymphaea lotus
und Bolbitis heudelottii.
Beneficial Elements sind Mineralstoffe, die von Pflanzen aufgenommen werden und ihre Gesundheit und ihr Wachstum verbessern, deren Fehlen aber keine Mangelsymptome verursacht. Sie werden nicht für Stoffwechselvorgänge benötigt.
Silizium wirkt Mangan-Toxizität entgegen, weil die Ionen um die Bindungsplätze an der Zellmembran konkurrieren.
Es wird wie Kalzium in Zellwände eingebaut. Harte Pflanzen wie Gräser, sowie Brennnesseln und Schachtelhalm enthalten Silizium.
Silizium ist auch Bestandteil der Schalen von Kieselalgen.
Bei einer künstlichen Zufuhr von Silizium (Blattdüngung) werden die Blätter von Cryptocorynen in der Sumpfkultur fester.
Quarzkies und Glas bestehen aus Siliziumoxid. Eine künstliche Zufuhr durch Düngung ist nicht notwendig.
Natrium ist liegt als Ion im Boden und auch im Zellsaft der Pflanze vor.
Es erhöht den Zellinnendruck, weil es osmotisch wirkt und den Zustrom von Wasser in die Zelle steigert.
Es ist in dieser Funktion aber ersetzbar (z. B. durch Kalium) und dient in der Pflanze keinem anderen Zweck.
Nicht alle Verfärbungen der Blätter, Deformationen oder Absterbe-Erscheinungen werden durch Nährstoffmängel oder Überdüngung verursacht. Neben verschiedenen Krankheiten kommen auch Lichtmangel, Sonnenbrand und Vergiftungen durch Pflanzenschutzmittel oder Schwermetalle in Frage.
Pflanzen benötigen Licht um Fotosynthese betreiben zu können. Pflanzen bilden rote Farbstoffe (meist Anthocyane
und Carotine), um ihr das Photosystem vor Zerstörung durch zu starke Strahlung schützen.
Bei Lichtmangel werden diese Farbstoffe abgebaut und die Pflanzen hellen sich auf und werden gelb. Rotblättrige Arten vergrünen.
Eine Aufhellung der Blätter ist auch bei Gemüsepflanzen (z. B. Bohnen, Salat, Spinat) zu sehen, wenn die Pflanzen zu lange mit einem Gemüseschutz-Vlies abgedeckt waren.
Pflanzen, die an schattige Standorte angepasst sind haben dunkelgrüne Blätter.
Sie haben besonders viel Chlorophyll. Dieses wird nicht durch andere Farbstoffe überlagert und kann
durch zu starkes Licht beschädigt werden. Im Aquarium stellen z. B. Anubias-Arten bei zu viel Licht ihr Wachstum ein.
Werden Pflanzen vom Zimmer ins Freie gestellt, bleichen sie aus und können sogar richtige Verbrennungen mit eingetrockneten Flecken entwickeln.
Solche Sonnenschäden sind oft bei Tomaten, Melonen und GurkenJungpflanzen zu sehen,
die im Haus vorkultiviert wurden und dann in den Garten kommen.
Sinken die Temperaturen Nachts unter 10 °C zeigen Warmhauskulturen wie Tomaten, Gurken, Paprika und Melonen auch Kälteschäden.
Hierbei bilden sich weiße Nekrosen in den Blättern und am Blattrand.
| Blei | Zink | |
| Ceratopteris thalictroides | 900 | 190 |
| Hygrophila polysperma | 700 | 170 |
| Myriophyllum elatinoides | 600 | 260 |
| Hydrocotyle leucocephala | 450 | stirbt ab |
| Ludwigia palustris | 350 | stirbt ab |
| Cabomba caroliniana | 200 | stirbt ab |
| Limnophila aquatica | 190 | 190 |
| Vallisneria spiralis | 120 | stirbt ab |
Im Garten sind Schäden durch Schwermetalle nicht zu erwarten. Sie spielen vor allem eine Rolle an Standorten, an denen Abraum aus der chemischen Industrie,
Schlacken oder Klärschlamm im Boden ist. Bei der Klärung von Haushalts- und Industrieabwässern wird versucht Schwermetalle so gut wie möglich zu entfernen.
Zu den Schwermetallen gehören Aluminium, Chrom, Barium, Titan, Cobald, Nickel, Cadmium und Blei. Es gehören aber auch Kalzium,
Magnesium, Eisen, Kupfer, Mangan
und Zink dazu, die als (Mikro)-Nährstoffe für die Pflanze wichtig sind. Besonders die Elemente, die keine Funktion in der
Pflanze haben, können zu schweren Vergiftungserscheinungen führen, weil sie schon bei geringen Dosen, Stoffwechselvorgänge behindern,
indem sie Bindungsstellen für andere Elemente belegen und dadurch zum Beispiel Enzyme zerstören. Dabei sind die Schäden durch
Messung von Stoffwechselaktivitäten deutlich früher zu bemerken als an Chlorosen oder Wuchshemmung, z. B. bei Nickel an Elodea canadensis
(Käkönen & Kairesalo 1998).
Bei einer Vergiftung durch Quecksilber beispielsweise nimmt der Gehalt an Chlorophyll, Proteinen, Stickstoff,
Phosphat und Kalium in Vallisneria spiralis innerhalb von 7 Tagen ab (Gupta & Chandra 1998).
Die meisten Elemente (Ca, Fe, Al, Cr, Cu, Ba, Ti, Co, Pb) werden vor allen in den Wurzeln eingelagert. Mangan, Zink und Magnesium
findet man vor allem im Stängel. Dabei nehmen die Pflanzen die für sie wichtigen Metalle
in größerem Maße auf, als die schädlichen (Vardanyan
& Ingole 2006).
Zink und Kupfer werden unabhängig von der Konzentration in der Außenlösung immer in konstanter Rate von 0,48 mg pro
Liter und Tag bzw. 0,11 mg pro Liter und Tag von Myriophyllum aquaticum, Ludwigia palustris und Mentha aquatica aufgenommen. Bei Quecksilber
und Eisen steigt die Aufnahmerate in Abhängigkeit von der Konzentration. Bei Quecksilber reicht die Spanne von 0,0002 bis 0,0787 mg pro Liter
und Tag. Bei Eisen von 0,41 bis 7,00 mg pro Liter und Tag (Kamal et al. 2004).
Auch Cadmium wird mit steigender Konzentration im Nährmedium vermehrt aufgenommen (Sivaci et al. 2004).
Die einzelnen Schwermetalle werden unterschiedlich schnell aufgenommen.
Nickel dringt zum Beispiel 25 bis 40 Mal schneller in Elodea canadensis als Chrom (Kahkönen et al. 1998).
In einem Versuch mit Vallisneria spinulosa wurde nachgewiesen, dass von der Mutterpflanze aufgenommenes Blei auch in die
Jungpflanzen gelangt. Die höchste Bleikonzentration wurde in den Wurzeln gefunden, danach absteigend in den Turionen, den Stolonen und die
niedrigste in den Blättern. Bereits bei einer Bleimenge von 40 µg pro Gramm Boden ist das Wachstum deutlich gesenkt. Die Enzyme Superoxiddismutase,
Katalase und Peroxidase zeigten eine deutlich
verringerte Aktivität (Yan X. et al. 2006).
Chrom wird von Salvinia herzogii und Eichhornia crassipes nur in geringen Mengen in die Blätter verlagert.
Eine Aufnahme über die Blätter ist aber möglich. (Maine et al. 2004)
Wie hoch die Konzentration an Schwermetallen sein darf hängt von der Pflanzenart ab. Mehr als 50 mg/l Blei ist
tödlich für Algen der Gattung Microspora (Axtell et al. 2003). Eichhornia crassipes verträgt bis zu 100 mg/l Blei. Wir dieses aber mit anderen
Schwermetallen zusammen angeboten sind bereits 3 mg/l tödlich (Soltan & Rashked 2001).
Die Fähigkeit von Wasserpflanzen Schwermetalle aufzunehmen macht man sich bei der Klärung von Abwässern zu Nutze. Interssant ist
darum die Frage welche Pflanzenarten besonders viel von welchem Schwermetall aufnehmen können, bevor sie absterben. Lee
et al. 1998 untersuchten 20 Wasserpflanzen und stellten fest, dass sie sehr unterschiedlich reagierten. Generell war die Empfindlichkeit
gegen Zink höher und viele der Versuchspflanzen überlebten den Versuchszeitraum nicht. Aber auch die Fähigkeit Blei einzulagern ist begrenzt. Die
Aufnahme wird irgendwann durch die Zerstörung der Enzyme behindert.
Interessant ist, dass verschiedene Versuche gezeigt haben, dass auch tote, getrocknete Pflanzenteile Schwermetalle einlagern.
Das bedeutet, das die Aufnahme passiv in die Zellwände erfolgt und nicht durch Stoffwechselaktivitäten.
Ergebnisse dazu gibt es für Eichhornia crassipes, Potamogeton natans und Ceratophyllum demsum (Schneider et al. 1995, Lacher & Smith 2002, Keshkinkan et al. 2004).

Wasser- und Sumpfpflanzen benötigen zum Wachsen die gleichen Nährstoffe wie Gemüsepflanzen oder Obstbäume.
Das Ökosystem im Garten ist nach allen Seiten offen und es gibt einen stetiger Austausch mit umliegenden Gebieten durch Wind, Regen, Zuflug von Staub und so weiter.
Im Boden finden ständig Verwitterungsprozesse statt und Mikroorganismen wandeln organische Masse um. Die Pflanzen haben so eine stetige Nachlieferung an Nährstoffen.
Im Gegensatz dazu ist das Aquarium ein geschlossenes System, dass nur durch das aktive Eingreifen des Menschen reguliert wird.
Auch hier findet der Umbau von organischer Masse statt und es werden Nährstoffe frei. Der Eintrag in das Aquarium hat aber ein unnatürliche Zusammensetzung,
weil er in Form verschiedener Fischfuttersorten erfolgt.
Dadurch sind oft einige Nährstoffe (Stickstoff, Phosphat) in zu großer Menge vorhanden und andere in zu geringer Menge (Kalium, Eisen, Kalzium).
Darum muss ein Aquarium regelmäßig gepflegt werden, um es für Pflanzen und Tiere in einem guten Zustand zu halten.
Neben regelmäßigen Wasserwechseln, gehört dazu auch die Düngung mit Kalium und Mikronährstoffen.
Durch eine ausgewogene Nährstoffversorgung sind Aquarienpflanzen in der Lage gesund zu wachsen und dabei
Makronährstoffe wie Nitrat und Phosphat aus dem Wasser zu entziehen.
Das macht sie zu Konkurrenten für Algen. Ist das Pflanzenwachstum durch den Mangel an einem oder mehreren
Nährstoffen gehemmt, kommt es zu einem Überschuss an Phosphat und/oder Nitrat und es bilden sich vermehrt Algen.
Nicht jeder Nährstoffmangel muss dabei sofort erkennbar sein. Manchmal sind es die Algen, die einen Hinweis auf ein
Ungleichgewicht in der Nährstoffversorgung geben.
Regelmäßige Wasserwechsel mit mittelhartem bis hartem Wasser versorgen Aquarienpflanzen ausreichend mit Calcium und Magnesium.
Kalium und Mikronährstoffe können auf diese Weise aber nicht genug zugeführt werden.
Mikronährstoffe müssen in einem angemessenen Verhältnis angeboten werden.
Eine Überdüngung an einem Nährstoff kann die Aufnahme eines andere behindern.
Ein Kombidünger aus Kalium, Eisen und allen anderen Mikronährstoffen ist darum immer zu empfehlen.
Durch die Fütterung kommen in die meisten Aquarien ausreichend große Mengen an Stickstoffverbindungen und Phosphat.
Teilweise ist aber entweder N oder P in zu großen Anteilen vorhanden.
Durch die Zugabe des jeweils anderen Nährstoffs kann die Aufnahme verbessert und mögliches Algenwachstum reduziert werden.
Für Pflanzen sind die Wasserwerte nicht "in Ordnung" wenn Nitrat und Phosphat nicht nachweisbar sind.
Beide Stoffe sind Makronährstoffe und für die Pflanze unverzichtbar.
Wie hoch der Bedarf eines Pflanzenbestandes an den einzelnen Nährstoffen ist hängt von der Art der Pflanzen,
dem Lichtangebot und der Temperatur ab. Hohe Temperaturen und viel Licht beschleunigen den Stoffwechsel und das Wachstum
und erhöhen so den Nährstoffbedarf. Wie viel gedüngt werden muss, muss Jeder für sein Aquarium selbst herausfinden,
da eine Teil des Bedarfs durch die Mineralisation von Futterresten und tierischen Ausscheidungen gedeckt wird.
Kein Nährstoff sollte jemals ganz fehlen.
Einige Pflanzen zeigen früher Mangelsymptome als andere. Man kann sie als Zeigerpflanzen verwenden.
Beispielsweise sind Hygrophila-Arten
sehr anfällig für Kalium-Mangel und bilden die typischen punktförmigen Nekrosen lange vor anderen Arten aus.
Ludwigia inclinata neigt dazu bei Mangel an Mikronährstoffen chlorotisch zu werden,
wenn unter den gleichen Bedingungen andere Ludwigien völlig problemlos wachsen.
Cabomba paliformis zeigt Eisenmangel viel früher als Cabomba caroliniana.
Die Ursachen für diese Unterschiede können in einer unterschiedlichen Befähigung zur Nährstoffaufnahme liegen,
die es der einen Pflanze ermöglicht geringere Nährstoffangebote zu nutzen als einer andere.
Pflanzen, die schneller wachsen, haben einen höheren Bedarf und zeigen schneller Mangelsymptome.
Möglicherweise ist aber das Milieu (pH-Wert, Temperatur) für eine Pflanze günstig, während die andere
sich unter den Bedingungen schwer tut.
| Licht limitiert (0,5 W/l) 1 |
Starklichtbecken 2 |
|
| Erntemenge an Pflanzenfrischmasse pro Liter im Monat |
2 g |
etwa 6,7 g |
| Nährstoffentzüge durch die Pflanzenmasse * |
||
| Stickstoff (N): 1,5 - 2 % in der Trockenmasse |
3 - 4 mg N = 9 - 12 mg Nitrat |
10,05 - 13,4 mg N = 31,5 - 40,2 mg Nitrat |
| Phosphor (P) : 0,2 - 0,5 % in der Trockenmasse |
0,4 - 1 mg P = 1,27 - 3,17 mg Phosphat |
1,34 - 3,35 mg P = 4,25 - 10,62 mg Phosphat |
| Kalium (K): 1 - 3 % in der Trockenmasse |
2 - 6 mg K+ |
6,7 - 20,1 mg K+ |
| Calcium (Ca): 0,5 - 1 % in der Trockenmasse |
1 - 2 mg Ca+ |
3,35 - 6,7 mg Ca+ |
| Magnesium (Mg): 0,2 - 0,4 % in der Trockenmasse |
0,4 - 0,8 mg Mg 2+ |
1,34 - 2,64 mg Mg 2+ |
| Eisen (Fe): 0,01 - 0,03 % in der Trockenmasse |
0,02 - 0,06 mg Fe |
0,067 - 0,20 mg Fe |
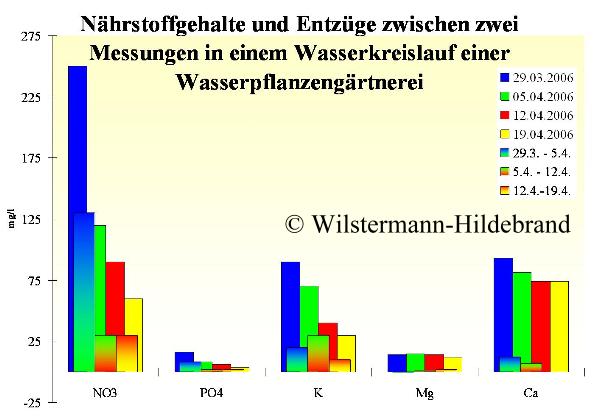
| Temperatur in °C | Sauerstoff in mg/l |
| 20 | 9,1 |
| 22 | 8,7 |
| 24 | 8,4 |
| 26 | 8,1 |
| 28 | 7,8 |
| 30 | 7,6 |
Wie viel Nährstoff in einem Aquarium verbraucht und gedüngt werden müssen hängt von verschiedenen Faktoren ab.
Die Art und Menge der Pflanzen spielt eine zentrale Rolle.
Ihr Nährstoffbedarf wird aber durch die Lichtstärke, die Temperatur und das Kohlendioxidangebot beeinflusst.
Der Nährstoffeintrag erfolgt durch die Zugabe von Futter und Dünger.
Die Menge der Tiere und die Art des Futters beeinflussen so die Zusammensetzung und die Menge dieser "Grunddüngung".
Mit Hilfe von Düngern werden dann die Nährstoffe nachgeliefert, die im Futter und im Leitungswasser nicht in ausreichender Menge vorhanden
sind. Meistens sind das Kalium, Eisen und andere Mikronährstoffe.
Manchmal kann es aber auch notwendig sein Stickstoff (z. B. Nitrat oder Ammonium) und Phosphat zu düngen.
Außer den Pflanzen nehmen auch Filterbakterien und andere Mikroorganismen im Filter und im Substrat
Nährstoffe auf. Der Nährstoffbedarf eines Aquariums wird dadurch individuell.
In der Tabelle rechts sind die Nährstoffmengen aufgeführt, die mit der "geernteten" Pflanzenmasse aus zwei verschiedenen Aquarien entfernt wurden.
Das Licht limitierte Aquarium war ein Altwasserbecken. Es wurde mit 0,5 W/l belichtet und ohne Kohlendioxiddüngung betrieben.
Das andere war ein Starklichtbecken mit optimierten Reflektoren, T5-Röhren und Kohlendioxiddüngung.
Es wird wöchentlich mit Phosphat, Kalium und Mikronährstoffdüngern gedüngt.
Es wurde von den Autoren das Gewicht der Pflanzenfrischmasse festgestellt, die durchschnittlich monatlich bei den Pflegearbeiten entfernt wurden.
Gemäß der durchschnittlichen Nährstoffgehalte in den Pflanzen, habe ich die Entzugsmengen für die Nährstoffe errechnet.
Die Pflanzen in dem Schwachlichtbecken entziehen in diesem Rechenbeispiel dem Wasser wöchentlich 2,25 - 3 mg Nitrat und 0,32 - 0,8 mg Phosphat pro Liter.
Im Starklichtbecken werden wöchentlich rund 7,9 - 10 mg Nitrat und 1,1 - 2,7 mg Phosphat pro Liter mit der Pflanzenmasse aus dem Aquarium entfernt.
In anderen Versuchen wurde die Abnahme der Nährstoffmenge im Aquarienwasser nach einer Düngung gemessen und so auf den täglichen Nährstoffbedarf des Aquariums geschlossen.
Gemessen wurde in Starklichtaquarien mit 450 µnol/m2/s (ca. 24.000 Lux an der Wasseroberfläche).
Je nach Pflanzenbewuchs wurden täglich 1 - 4 mg/l Nitrat und 0,2 bis 0,6 mg/l Phosphat verbraucht (Coring 2009).
Das ist etwas weniger als in dem Starklichtbecken von Kramer.
Das liegt vermutlich daran, dass im Aquascaping vor allem kleinbleibende Pflanzen verwendet werden, die wenig Blattmasse bilden,
während Kramer ein Stängelpflanzen-Fan ist, der wöchentlich viel zu schneiden hat.
In dem Diagramm ist zu erkennen, das mit sinkendem Angebot an Nitrat auch die Aufnahme durch die Pflanzen sinkt.
In der ersten Woche entziehen die Pflanzen der Nährlösung etwa 130 mg Nitrat pro Liter. Der Rest von etwa 120 mg/l sollte eigentlich innerhalb der nächsten Woche verbraucht werden.
Tatsächlich entzogen die Pflanzen dem Wasser dann aber nur noch jeweils 30 mg Nitrat pro Liter.
Der hier untersuchte Pflanzenbestand nahm konstant Nitrat und Phosphat in einem Verhältnis von etwa 15:1 auf.
Ab der zweiten Woche wurde die Aufnahme von Nitrat durch den Mangel an Phosphat begrenzt.
Diese Phänomen gilt auch für das Aquarium. Man kann die Nitratwerte im Wasser senken, wenn man Phosphat düngt und umgekehrt.
Bei zu geringem Nährstoffangebot, wird die Aufnahme durch die Pflanzen erschwert.
Kramer (2009) gibt an, dass Hygrophila odora beispielsweise einen Phosphatgehalt von mindestens 0,3 mg/l benötigt.
Ausgehend von den errechneten Nährstoffentzügen und der Bedingung, dass eine Minimumkonzentration erhalten bleiben muss, kann man nun einige Faustzahlen für den Nährstoffbedarf
aufstellen. Bei einer wöchentlichen Düngung müssen etwa folgende Nährstoffgehalte angestrebt werden.
Nitrat: 5 - 30 mg/l
Phosphat: 0,2 - 2,5 mg/l
Kalium: 10 - 30 mg/l
Eisen: 0,01 - 0,3
Bei einigen Pflanzen ist es günstiger die Nährstoffe nicht als Stoßdüngung
wöchentlich zuzugeben, sondern mehrmals in der Woche oder täglich zu düngen. Cryptcorynen vertragen beispielsweise
Kalium-Werte über 20 mg/l nicht und können mit einem Zerfallen der Blätter reagieren.
Bei Nesaea und Ammannia können Nitratwerte über 10 mg/l Nitrat Verkrüppelungen der Triebspitzen
auslösen. Ein zu hoher Eisenwert, kann die Aufnahme von Mangan und anderen Mikronährstoffen behindern.
Wenn wir uns mit der Frage beschäftigen, wieviele Nährstoffe und welche wir unseren Aquarienpflanzen anbieten
müssen, dann suchen wir oft Hinweise in den Wasser- und Bodengrundanalysen von
Naturstandorten. Leider sind diese aus vielen Gründen nicht geeignet um uns bei der Düngung im Aquarium zu helfen.
Grundsätzlich müssen wir feststellen, dass sehr viel mehr Nährstoffe als wir allgemein vermuten über die
Wurzeln aus dem Substrat aufgenommen werden (Gentner 1977, Moeller et al. 1988, Wigand
et al. 2001). Wasseranalysen, die nur extrem geringe Nährstoffgehalte anzeigen sind also irreführend, wenn keine Bodengrundanalyse vorliegt.
In natürlichen Gewässern schwanken die Wasserwerte im Jahresverlauf, weil bei erhöhten Niederschlagsmengen oder bei
Schneeschmelze eine Verdünnung auftritt bzw. im Jahresverlauf durch den Eintrag von Pollen, Blättern und anderem organischen Material auch der Input variiert.
Beispielsweise schwankt der Nitratgehalt an einem Meßpunkt im Rio Parana im Jahresverlauf zwischen 0,4 und 4 mg/l und der pH-Wert
zwischen 6,6 und 7,4. An einer anderen Stelle sind die Nährstoffgehalte dagegen fast unverändert, während der pH-Wert den gleichen
Schwankungen unterliegt (Maine et al. 2004). Es hängt also davon ab zu welcher Jahreszeit und bei welchem Wasserstand die
Meßwerte erhoben werden.
Außerdem wachsen Pflanzen in der Natur nicht dort, wo sie optimale Bedingungen für besonders buschiges, schnelles
Wachstum mit schön gefärbten, unbeschädigten Blättern haben.
Vielmehr besiedeln sie die Stellen, an denen sie akzeptable Umweltbedingungen
vorfinden, aber andere Pflanzen aus irgendwelchen Gründen nicht wachsen können, weil beispielsweise die Salzkonzentration zu hoch, die
Wasserversorgung zu schwankend, die Strömung zu stark oder das Licht nicht ausreichend
ist. Pflanzen verändern durch ihre Anwesenheit das Millieu. Die Analysen im
Pflanzenbestand und einige Meter davon entfernt unterscheiden sich darum. Die Unterschiede
sind dann aber oft nicht der Grund dafür, dass die Pflanzen an der einen Stelle wachsen und nicht an der anderen, sondern die Folge davon.
Besonders schwerwiegend ist aber, dass die Analysen möglicherweise fehlerhafte Ergebnisse erzielen. Wasserproben müssen wegen der
biologischen Aktivität von Algen und Bakterien sofort analysiert werden. Durch den Verbrauch von Sauerstoff verändert sich der
pH-Wert.
Denitrifizierende und nitrifizierende Bakterien wandeln Stickstoffverbindungen weiter um und erzeugen so Zusammensetzungen, die in dem
natürlichen Gewässer nicht vorliegen. Algen verbrauchen Nährstoffe oder sterben ab, wodurch wiederum Nährstoffe frei werden können. Kurz:
Nachdem eine Wasserprobe mehrere Stunden bei tropischen Temperaturen gestanden hat oder auf eine Schotterpiste durchgeschüttelt wurde, hat
es nichts mehr mit dem vom natürlichen Standort gemein.
Die Analyse selbst ist oft auch erschwert. Beispielweise können bei Tropftests Farbveränderungen gar nicht oder nur
schwer beurteilt werden, wenn man es mit teebraunem Schwarzwasser zu tun hat.
Besonders weiches Wasser lässt sich schlecht messen, weil beispielsweise viele Gesamthärtetests eine Härte von mindestens 3 °dGH voraussetzen.
Auch pH-Testreagenzien funktionieren in Weichwasser nur sehr ungenau.
Abweichungen bis zu 3 pH-Stufen zwischen einem Tropftest und der Messung mit einem Meßgerät
sind möglich. Tests deren Ergebnis an die Temperatur gebunden sind, können unter tropischen Bedingungen extreme Ungenauigkeiten erzeugen.
Beispielsweise altern einige Reagenzien für Sauerstofftests bei hohen Temperaturen sehr schnell. Dadurch muss mehr Reagenz verwendet werden
um den gewünschten Farbumschlag zu erreichen und der Meßergebnis ist deutlich zu hoch.
Auch elektronische Meßgeräte sind nicht zu 100% zuverlässig. Durch die hohe Luftfeuchtigkeit kann es zu
Kondenswasserbildung kommen, die Kriechströme verursachen kann. Es empfiehlt sich die Meßgeräte
zusammen mit dem Feuchtigkeit ziehenden Kiesel-Gel zu verpacken.
Es gibt viele Unklarheiten darüber, wie und in welcher Form Nährstoffe von den Pflanzen aufgenommen werden.
Beispielsweise wird immer wieder behauptet, dass Aquarienpflanzen ihre Nährstoffe vor allem über die Blätter aufnehmen und darum keinen
Dünger im Bodengrund benötigen. Außerdem sollen sie Ammonium lieber/besser/schneller verwerten als Nitrat. Beide Behauptungen sind falsch!
Es gibt sowohl unter den Landpflanzen als auch unter den Wasserpflanzen solche, die bevorzugt Ammonium (NH4+)
aufnehmen aber auch solche, die Nitrat (NO32-) bevorzugen.
Beim Rohrkolben (Typha orientalis) hat die Form der Stickstoffverbindung keinen Einfluss auf dessen Aufnahme (Cary
& Weerts 1984).
Bei submersen Pflanzen im Aquarium spielt Ammonium so gut wie keine Rolle, weil es sofort über die Abbaukette in Nitrat umgewandelt wird.
Wasserpflanzen sind nicht alle in der Lage sämtliche Nährstoffe in ausreichender Menge über die Blätter aufzunehmen.
Untergetaucht lebende Sumpfpflanzen wie Echinodorus und Cryptocoryne
schon gleich gar nicht.
Najas wächst sowohl frei treibend ohne Wurzeln oder mit Wurzeln, als auch im Substrat verankert. Oft wird daraus
geschlossen, dass die Pflanzen ihren Nährstoffbedarf aus dem Wasser allein decken und darum keine Düngung über den Bodengrund benötigen.
Bei den Sämlingen von Najas flexilis wurde nachgewiesen, dass sie mehr als 99 % ihres Phosphorbedarfs aus dem Sediment decken
(Moeller et al. 1988). Die Pflanzen können zwar frei treibend
überleben, ihre Versorgung ist aber deutlich besser, wenn sie über den Bodengrund mit Nährstoffen versorgt werden.
Es werden auch nicht alle Nährstoffe gleich gut über die Blätter aufgenommen. Vallisneria spiralis
kann zum Beispiel Phosphat in gleichem Maße mit den Blättern aus dem Wasser wie mit den Wurzeln aus dem Boden aufnehmen. Die Aufnahme
von Eisen über die Blätter ist aber auf einen kleinen Bereich der Wachstumszone beschränkt. Voll entwickelte Blätter
können von Eisen nicht mehr durchdrungen werden. Für eine ausreichende Versorgung müssen die Pflanzen darum Eisen über die Wurzeln aufnehmen (Gentner 1977).
Untersuchungen haben gezeigt, dass Pflanzen mit einem ausladenden, tiefgehendem Wurzelsystem mehr Nährstoffe aus dem
Boden entziehen, als wenig bewurzelte. Vallisneria americana kann zum Beispiel dem Boden mehr Phosphat (PO4-) entziehen als Potamogeton pectinatus
(Wigand et al. 2001). Das ist nicht wirklich ein überraschendes Ergebnis.
Interessant ist aber, dass sich im Boden unter Pflanzenbeständen deutlich mehr Nährstoffe befinden als auf freien Flächen. Die Pflanzen
sind in der Lage Nährstoffe im Sediment zu deponieren und im Folgejahr davon zu profitieren.
Das Angebot an Stickstoff und Phosphat wirkt sich direkt auf den Habitus der Pflanze aus. Beispielsweise wird bei Elodea canadensis,
Elodea nuttallii und Lagarosiphon major der Anteil der Wurzelmasse an der Gesamtpflanzenmasse mit zunehmendem Nährstoffangebot immer
geringer (James et al. 2006).
Diese Beobachtung kann man auch bei vielen Landpflanzen machen. Ist ihre Nährstoffaufnahme
begrenzt, bilden sie mehr, längere und verzweigtere Wurzeln aus um die geringen vorhandenen Mengen im Boden besser auszuschöpfen. Die
Trockenmasse der Wurzeln von Vallisneria americana nimmt dagegen mit steigendem Phosphatangebot im Sediment deutlich zu, während
sich sich die Blattmasse nur wenig verändert. Diese Art reagiert also anders herum.
Das Angebot in der Natur liefert uns also kaum eine Aussage darüber welche Zusammensetzung und Menge in der
Nährstoffversorgung optimal sind. Es liegt also nahe sich die Zusammensetzung der Pflanzenmasse
an zu sehen um auf die Mengenverhältnisse zu schließen. Dazu bräuchte man ja eigentlich nur gut entwickelte Pflanzen
analysieren und ihre Nährstoffgehalte mit denen von Mangelpflanzen vergleichen.
Solche Analysen zeigen deutlich, dass Pflanzenarten unterschiedliche Nährstoffzusammensetzungen
haben und dass es deutliche Schwankungen in Abhängigkeit von den Kulturbedingungen gibt.
Unglücklicherweise treten Mangelerscheinungen einmal früher und einmal später auf. Das ist abhängig von der
sonstigen Nährstoffversorgung der Pflanze. Beispielsweise kann Natrium einen Teil der physiologischen Aufgaben von Kalium bei der Regulation des
Wasserhaushalts übernehmen. Entsprechend treten den Wasserhaushalt betreffende
Mangelsymptome erst später auf, wenn die Natriumzufuhr besser ist.
Auch sind Pflanzen individuell unterschiedlich anfällig und zeigen Chlorosen nicht unbedingt sofort. Das Auftreten von
Chlorosen oder Nekrosen ist außerdem ein Zeichen für extrem starken Nährstoffmangel.
Ein latenter Mangel wird oft nicht bemerkt.

Literatur:
S.R. Gentner (1977): Uptake and transport of iron and phosphate by Vallisneria spiralis.- Aquatic Botany 3, 267-272
P.R. Cary, P.G.J. Weerts (1983b): Growth of Salvinia molesta as affected by water temperature and nutrition II. Effects of phosphorus level.- Aquatic Botany 17, 61-70
P.M. Room, J. Y. Gill (1984): The chemical environment of Salvinia molesta Mitchelli: Ion concentration of infestet water.- Aquatic Botany 23, 127-135
P.R. Cary, P.G.J. Werts (1984): Growth and nutrient composition of Typha orientalis as affected by water temperature and nitrogen and phosphorus supply.- Aquatic Botany 19, 105-118
J.A.A. Schuurkes, C.J. Kok, C. Den Hartog (1986): Ammonium und nitrate uptake by aquatic plants from poorly buffered and acified Waters.- Aquatic Botany, 24, 131-146
R.E. Moeller, J. M. Burkholder, R. G. Wetzel (1988): Significance of sedimentary phosphorus to a rooted submersed macrophyte (Najas flexilis (WILLD.) ROSTK. SCHMIDT) and its algal epiphythes.- Aquatic Botany, 32 (1988) 261-281
J. Kluczniok (1989): Erfahrung mit Blaualgen und Kaliumsulfat.- AP 3-89, 106-107
R. Barbieri, F. de Assis Esteves: (1991): The chemical composition of some aquatic macrophyte species and implications for the metabolism of a tropical lacustrine ecosystem - Lobo Reservoir, Sao Paulo, Brazil.- Hydrobiologia 213, 133-140
W. Bergmann (1993): Ernährungsstörungen bei Kulturpflanzen.- 3. Auflage, Gustav Fischer Verlag Jena
A. Amber (1996): Pflanzenernährung.- 4. Auflage, UTB
C.-L. Lee, T. C. Wang, C.-H. Hsu, A.-A. Chiou (1998): Heavy Metal Sorption by Aquatic Plants in Taiwan.- Bull. Environ. Contam. Toxicol. 61, 497-504
H.-G. Kramer (2001): Problempflanzen.- Aqua-Planta 2-2001, 86-92
C. Wigand, M. Finn, St. Findlay, D. Fischer (2001): Submersed macrophyte effects on nutrient exchanges in Riverine sediments.- Estuaries Vol. 24 (3), 398-406
H. Kleemann (1990): Ein Rezept für eine Düngermischung für Wasserpflanzen.- AP 1-90, 7-9
M. E. Meade, S. A. Watts (1995): Toxicity of Ammonia, Nitrite, and Nitrate to juvenile australian Crayfish, Cherax quadricarinatus.- Journal of Shellfish Research, Vol. 14, No. 2. 341-346, 1995
S. Körner (2002): Loss of submerged macrophytes in shallow lakes in north-eastern Germany.- Interant. Rev. Hydrobiology 87 (4), 375-384
R. Herr (2002): Kultur und Ernährung von Wasserpflanzen.- Aquaristik Fachmagazin 34(5), 66-68
Crosey (2002): The Effect of Water Flow, pH and Nutrition on the Growth of the Native Aquatic Plant Aponogeton elongatus.- Dissertation, University of Queensland, Gatton
L. Marion, J.- M. Paillisson (2003): A mass balance assessment of the contribution of floating-leaved macrophytes in nutrient stocks in an eutrophic macrophyte-dominated lake.- Aquatic Botany 75 (2003) 249-260
M. A. Maine et al. (2004): Nutrient concentration in the Middle Parana River: effect of the floodplain lakes.- Arch. Hydrobio. 160, (1), 85-103
Yonghong Xie, Dan Yu, Bo Ren (2004): Effects of nitrogen and phosphorus availability on the decomposition of aquatic plants.- Aquatic Botany 80, 29-37
L.G. Vadanyan, B. S. Ingole (2006): Studies on heavy metal accumulation in aquatic macrophytes from Savan (Armenia) and Carambolim (India) lake systems.- Environmental International 32 (2), 208-218
C. S. James, J.W. Eaton, K. Hardwick (2006): Response of three invasive aquatic macrophytes to nutrient enrichment do not explain their observed field displacement.- Aquatic Botany 84 (4), 347-353
Yan X., Yu D., Li YK. (2006): The effects of elevated CO2 on clonal growth and nutrient content of submerge plant Vallisneria spinulosa.- Chemosphere 60(4), 595-601
Yan X., Yu D., Wang H., Wang J. (2006): Response of submerged plant (Vallisneria spinulosa) clones to lead stress in the heterogenous soil.- Chemosphere 63(9), 1459-1465
T. Coring (2009): Aquascaping und Düngekonzepte.- Amazonas 26, 38-42
H.-G. Kramer (2009): Pflanzenaquaristik á la Kramer, Tetra Verlag GmbH
H. Laber, G. Lattauschke (2014): Gemüsebau.- 3. Auflage, Ulmer Verlag Stuttgart
Wilstermann-Hildebrand, M. (2014): Mangelsymptome an Aquarienpflanzen.- Amazonas 55, 71-75
Wilstermann-Hildebrand, M. (2015): Einfluß von Wasserpflanzen auf ihre Umwelt.- Amazonas 62, 64 - 67

© Wilstermann-Hildebrand 2000 - 2025
Impressum
Datenschutzerklärung